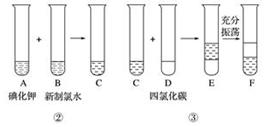
题目内容
18.把5.3%的Na2CO3溶液蒸发掉60g水后,溶液变为20mL,浓度变为15.9%,则浓缩后Na2CO3溶液的物质的量浓度为多少?分析 根据浓缩过程中碳酸钠的质量不变计算原溶液的质量,结合质量分数计算碳酸钠的质量,再根据c=$\frac{n}{V}$计算浓缩后碳酸钠溶液的物质的量浓度.
解答 解:假设5.3%的Na2CO3溶液的质量为mg,则:
mg×5.3%=(mg-60g)×15.9%,
解得:m=90g
故碳酸钠的质量为:90g×5.3%=4.77g,其物质的量为:$\frac{4.77g}{106g/mol}$=0.045mol,
则浓缩后碳酸钠溶液的物质的量浓度为:$\frac{0.045mol}{0.02L}$=2.25mol/L,
答:浓缩后Na2CO3溶液的物质的量浓度为2.25mol/L.
点评 本题考查溶液浓度有关计算,涉及质量分数、物质的量浓度的计算,题目难度不大,明确质量分数、物质的量浓度的概念及表达式为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
8.已知:4HCl(g)+O2 (g)?12C12 (g)+2H2O(g)△H=-123kJ.mol-1.其中相关的化学键键能数据如下:
其中a值为( )
| 化学键 | H-Cl | O═O | Cl-Cl | H-O |
| E/(kJ•mol-1) | 431 | 397 | a | 465 |
| A. | 242 | B. | 303.5 | C. | 180.5 | D. | 365 |
9.下列图示实验正确的是( )
| A. |  除去粗盐溶液中不溶物 | B. |  碳酸氢钠受热分解 | ||
| C. |  制取少量Cl2 | D. |  稀硝酸与铜的反应制取并收集NO |
6.下列离子方程式正确的是( )
| A. | 氧化铜与硫酸溶液反应:Cu2++2H+═Cu2++H2O | |
| B. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++H2O+CO2↑ | |
| C. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | 钠投入到水中:Na+H2O═Na++OH-+H2↑ |
13.下列关于化学反应的自发性叙述中正确的是( )
| A. | △H<0且△S>0的反应肯定是不自发的 | B. | △H<0且△S<0的反应肯定是自发的 | ||
| C. | △H>0且△S>0的反应肯定是自发的 | D. | △H<0且△S>0的反应肯定是自发的 |
7.下列关于物质分类正确组合是( )
| 分类组合 | 碱 | 酸 | 盐 | 氧化物 |
| A | Na2CO3 | H2SO4 | NaCl | CO2 |
| B | NaOH | HCl | NaHCO3 | H2SiO3 |
| C | NaOH | H2CO3 | CaCl2 | SO2 |
| D | KOH | NaHSO4 | CaCO3 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
2. 实验室制取溴乙烷的主反应如下:
实验室制取溴乙烷的主反应如下:
NaBr+H2SO4→HBr+NaHSO4
C2H5OH+HBr?C2H5Br+H2O
副反应:在该实验中经常会有乙醚、溴等副产物生成,装置如图所示.
实验步骤:
①向A中先加入5mL 95%的无水乙醇(0.085mol)和4.5mL的水,加入溴化钠7.725g,再加入沸石,摇匀.在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中.
②在B中加入9.5mL浓硫酸(0.17mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加入沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g.
回答问题:
(1)仪器E的名称为冷凝管;反应装置中有使用C、D两根温度计,其中D温度计的作用是:D温度计用来测反应体系的温度
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是溴乙烷沸点低、极易挥发,冰水主要可以防止溴乙烷的挥发.饱和亚硫酸氢钠溶液的作用是除去反应中的副产物溴;
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有abd(填标号).
a.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 d.减少因浓硫酸氧化HBr而生成副产物溴;
(4)步骤③中分出馏出液中有机层的操作名称为分液.加入浓硫酸除杂后的溶液明显分层,粗产物在上层(填“上”或“下”);
(5)本实验的产率为64%.
 实验室制取溴乙烷的主反应如下:
实验室制取溴乙烷的主反应如下:NaBr+H2SO4→HBr+NaHSO4
C2H5OH+HBr?C2H5Br+H2O
副反应:在该实验中经常会有乙醚、溴等副产物生成,装置如图所示.
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
①向A中先加入5mL 95%的无水乙醇(0.085mol)和4.5mL的水,加入溴化钠7.725g,再加入沸石,摇匀.在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中.
②在B中加入9.5mL浓硫酸(0.17mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加入沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g.
回答问题:
(1)仪器E的名称为冷凝管;反应装置中有使用C、D两根温度计,其中D温度计的作用是:D温度计用来测反应体系的温度
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是溴乙烷沸点低、极易挥发,冰水主要可以防止溴乙烷的挥发.饱和亚硫酸氢钠溶液的作用是除去反应中的副产物溴;
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有abd(填标号).
a.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 d.减少因浓硫酸氧化HBr而生成副产物溴;
(4)步骤③中分出馏出液中有机层的操作名称为分液.加入浓硫酸除杂后的溶液明显分层,粗产物在上层(填“上”或“下”);
(5)本实验的产率为64%.
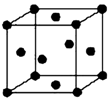 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.