题目内容
13.向20mL 0.1mol/L NH4HSO4溶液中滴入0.1mol/L NaOH溶液,下列说法正确的是( )| A. | 当滴入20mL NaOH溶液时:c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(SO42-) | |
| D. | 当滴入30mL NaOH溶液时,所得溶液pH>7:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
分析 A.加入20mL氢氧化钠溶液时反应生成等浓度的硫酸铵和硫酸钠,根据物料守恒分析;
B.由于铵根离子部分水解,则c(SO42-)>c(NH4+),结合电荷守恒判断;
C.硫酸根离子带有2个单位负电荷,电荷守恒中SO42-浓度计量数应为2;
D.反应后溶质为硫酸铵、一水合氨、硫酸钠,溶液显碱性,NH3•H2O的电离大于NH4+的水解,c(NH3•H2O)<c(NH4+).
解答 解:A.当滴入20mL NaOH溶液时,硫酸氢铵与氢氧化钠溶液恰好反应生成等浓度的硫酸铵、硫酸钠,根据硫酸铵中的物料守恒可知:c(SO42-)=c(NH3•H2O)+c(NH4+),故A正确;
B.溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知:2c(SO42-)=c(NH4+)+c(Na+),由于NH4+水解,故NH4+浓度小于SO42-,则c(Na+)>c(SO42-),溶液中正确的离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),故B错误;
C.根据溶液中的电荷守恒可知:c(H+)+c(Na+)+c(NH4+)=c(OH-)+2c(SO42-),故C错误;
D.当滴入30mL NaOH溶液时,所得溶液pH>7,溶液显碱性,NH3•H2O的电离大于NH4+的水解,c(NH3•H2O)<c(NH4+),正确的离子浓度大小关系为:c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| B. | 在标准状况下,2.24L乙烷中含有的化学键数为0.6NA | |
| C. | 100mL 0.1mol•L-1 Na2SO4溶液中含有的O原子数为0.04NA | |
| D. | 25℃时,1.0L pH=3的CH3COOH溶液中含有的H+数小于10-3 NA |
4.下列用于解释事实的方程式中,不合理的是( )
| A. | 氯水应保存在棕色试剂瓶内:2HClO$\frac{\underline{\;光照\;}}{\;}$H2O+Cl2↑ | |
| B. | 氯水具有杀菌、漂白作用:Cl2+H2O?HCl+HClO | |
| C. | 将氯水滴到淀粉KI试纸上,试纸变蓝:Cl2+2I-=2Cl-+I2 | |
| D. | 在实验室用漂白液和适量稀盐酸制取少量氯水:ClO-+Cl-+2H+=Cl2+H2O |
18.化学与生活、生产密切相关.下列叙述错误的是( )
| A. | 过氧化钠可用作呼吸面具中的供氧剂 | |
| B. | 向海水中加净水剂明矾可使海水淡化 | |
| C. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| D. | 服用抗氧剂维生素C有利于人体对铁元素的吸收 |
5.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}/高温}{→}$SiCl4$\stackrel{H_{2}/高温}{→}$Si | |
| D. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{△}{→}$MgCl2(s)$\stackrel{电解}{→}$Mg |
2.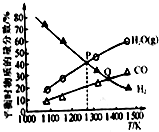 反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )
反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )
 反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )
反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )| A. | 容器内的总压:P点<Q点 | |
| B. | 正反应速率:v(Q)<v(P) | |
| C. | P点对应温度时,H2的平衡转化率为40% | |
| D. | P点对应温度的平衡常数的值为2.5×10-3 |
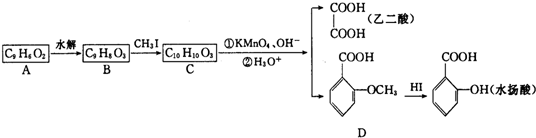
 .
.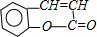 +H2O$\stackrel{酸}{→}$
+H2O$\stackrel{酸}{→}$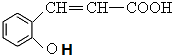 .
.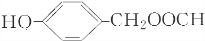 、
、 .
.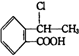 合成
合成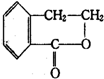 (其他无机原料自选,用反应流程图表示,并注明反应条件).示例:原料$→_{条件}^{试剂}$…产物.
(其他无机原料自选,用反应流程图表示,并注明反应条件).示例:原料$→_{条件}^{试剂}$…产物.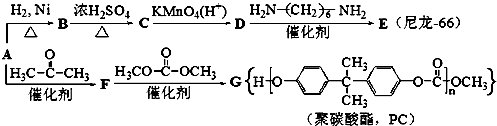
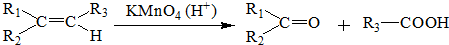
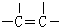 .
.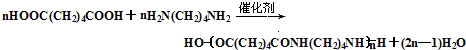 .
.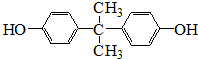 .
.