题目内容
5.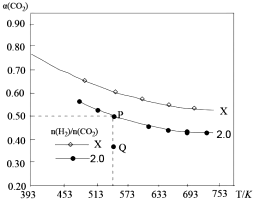 在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 氢碳比为2.0时.Q点v(H2)逆小于P点的v(H2)逆 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4•H2O,再次平衡后a(CO2)减小 |
分析 A.由图象可知温度升高CO2的转化率降低,说明平衡逆向移动,则△H<0,结合△H-T•△S<0能自发进行判断;
B.氢碳比越大,二氧化碳转化率越大;
C.在氢碳比为2.0时,P点达平衡,Q点未达平衡,此时二氧化碳的转化率比平衡时小,说明此时要继续转化更多的二氧化碳,反应物浓度在减小,生成物浓度在增大,正反应速率在减小,逆反应速率在增大,所以此时逆反应速率比平衡时逆反应速率小;
D.按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,相当于再按照4:10充入CO2、H2,氢碳比大于2.
解答 解:A.由图象可知温度升高CO2的转化率降低,说明平衡逆向移动,则△H<0,由△S<0可知,则高温下△H-T•△S>0,不能自发进行,故A错误;
B.由图象可知X的碳氢比不等于2,在相同条件下反应达平衡时,二氧化碳的转化率增大了,说明是增大了氢气的量,提高二化碳的转化率,即碳氢比越大,二氧化碳转化率越大,故B错误;
C.在氢碳比为2.0时,P点达平衡,Q点未达平衡,此时二氧化碳的转化率比平衡时小,说明此时要继续转化更多的二氧化碳,反应物浓度在减小,生成物浓度在增大,正反应速率在减小,逆反应速率在增大,所以此时逆反应速率比平衡时逆反应速率小,故C正确;
D.按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,相当于再按照4:10充入CO2、H2,氢碳比大于2,则次平衡后a(CO2)增大,故D错误.
故选C.
点评 本题考查化学平衡计算与影响因素、平衡常数、化学平衡图象等,为高频考点和常见题型,侧重考查对图象的分析获取信息能力,有一定难度.

练习册系列答案
相关题目
13.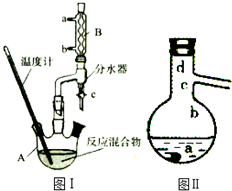 乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
Ⅰ.将混合液(18.5mL正丁醇和13.4mL乙酸(过量),0.4mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟.
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤.
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1g乙酸正丁酯.
部分实验数据如表所示:
(1)仪器A的名称是三颈烧瓶使用分水器(实验中可分离出水)能提高酯的产率,其原因是不断分离出水,使容器内H2O浓度变小,有利于平衡向酯化反应方向移动
(2)步骤Ⅱ中的操作顺序为①③①②(填序号),用Na2CO3溶液洗涤的目的是除去残留在产品中的酸,试剂X不能选用下列物质中的b(填字母序号).
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示).
①蒸馏过程中需要使用直形冷凝管,当仪器连接好后,
a.向相应的冷凝管中通冷凝水;
b.加热蒸馏烧瓶的先后顺序是先a后b.(填“先a后b“或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的a、b(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质.
(4)该实验乙酸正丁酯的产率是74%(计算结果保留2位有效数字).
 乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:Ⅰ.将混合液(18.5mL正丁醇和13.4mL乙酸(过量),0.4mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟.
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤.
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1g乙酸正丁酯.
部分实验数据如表所示:
| 化合物 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 溶解度(g)/(100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 乙酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 1 1 6 | 0.882 | 126.1 | 0.7 |
(2)步骤Ⅱ中的操作顺序为①③①②(填序号),用Na2CO3溶液洗涤的目的是除去残留在产品中的酸,试剂X不能选用下列物质中的b(填字母序号).
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示).
①蒸馏过程中需要使用直形冷凝管,当仪器连接好后,
a.向相应的冷凝管中通冷凝水;
b.加热蒸馏烧瓶的先后顺序是先a后b.(填“先a后b“或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的a、b(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质.
(4)该实验乙酸正丁酯的产率是74%(计算结果保留2位有效数字).
10.实验室制备乙酸乙酯(CH3COOCH2CH3)时有如下副反应:
2CH3CH2OH$?_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
相关有机化合物的一些性质如下表:
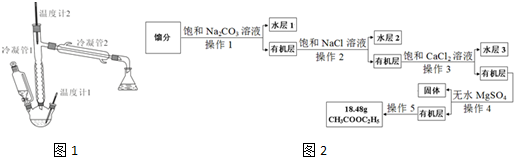
(CH3COOC2H5在饱和盐溶液中溶解度较小,C2H5OH能与CaCl2生成配合物)装置如图1所示(加热、支撑等装置略去).在三口瓶内先装入10mL95%乙醇与6mL浓硫酸混合液,并加入几粒沸石.在恒压滴液漏斗中加入15mL冰醋酸与15mL无水乙醇的混合液.加热,由恒压滴液漏斗逐滴加入混合液,并保持滴加速度与馏出液滴速度相近.保持反应液体温度在120-125℃,收集馏分.
(1)写出实验室制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH$?_{120-125℃}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(2)①加热三口瓶,最好的方法是C(填选项).
A.水浴 B.酒精灯 C.油浴 D.酒精喷灯
②若滴加液体速度太快会造成多种不利影响,其一是反应液体温度下降过快.
(3)产物提纯的流程如图2:
①操作1的名称是分液,操作5的名称是蒸馏.
②加入饱和Na2CO3溶液的目的是为了除去醋酸.
③加入饱和NaCl溶液是为了除去有机层中少量Na2CO3,其目的是防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗.
④加入饱和CaCl2溶液的目的是为了除去CH3CH2OH,加入无水MgSO4的目的是为了除去水.
⑤乙酸乙酯的产率是80%.
2CH3CH2OH$?_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
相关有机化合物的一些性质如下表:
| 分子式 | 相对分子 质量 | 熔点 /℃ | 沸点 /℃ | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | |||||
| CH3COOH | 60 | 16.6 | 117.9 | 1.05 | 互溶 | 互溶 | 互溶 |
| C2H5OH | 46 | -117.3 | 78.5 | 0.8 | 互溶 | / | 互溶 |
| CH3COOC2H5 | 88 | -83.58 | 77.1 | 0.9 | 可溶 | 互溶 | 互溶 |
| C2H5OC2H5 | 74 | -116.2 | 34.51 | 0.7 | 可溶 | 互溶 | / |

(1)写出实验室制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH$?_{120-125℃}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(2)①加热三口瓶,最好的方法是C(填选项).
A.水浴 B.酒精灯 C.油浴 D.酒精喷灯
②若滴加液体速度太快会造成多种不利影响,其一是反应液体温度下降过快.
(3)产物提纯的流程如图2:
①操作1的名称是分液,操作5的名称是蒸馏.
②加入饱和Na2CO3溶液的目的是为了除去醋酸.
③加入饱和NaCl溶液是为了除去有机层中少量Na2CO3,其目的是防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗.
④加入饱和CaCl2溶液的目的是为了除去CH3CH2OH,加入无水MgSO4的目的是为了除去水.
⑤乙酸乙酯的产率是80%.
14.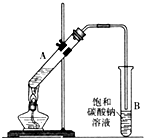 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
副反应:
C2H5OH+C2H5OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6mL乙醇、4mL乙酸和4mL浓硫酸,这三种试剂的添加顺序依次为乙醇、浓硫酸、乙酸
(2)试管B中导管接近液面未伸入液面下的理由是防止发生倒吸
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77.1℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生大量的酸性废液污染环境,有副反应发生
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释:CH3COOH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
C2H5OH+C2H5OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6mL乙醇、4mL乙酸和4mL浓硫酸,这三种试剂的添加顺序依次为乙醇、浓硫酸、乙酸
(2)试管B中导管接近液面未伸入液面下的理由是防止发生倒吸
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77.1℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生大量的酸性废液污染环境,有副反应发生
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释:CH3COOH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
15.下列热化学方程式叙述正确的是( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol (燃烧热) | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol (反应热) | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
 2NH3(g) ΔH<-38.6 kJ·mol-1
2NH3(g) ΔH<-38.6 kJ·mol-1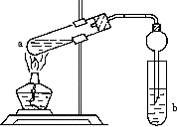 如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
 .
.