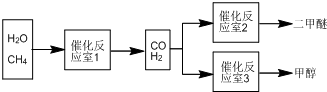
题目内容
17.硼及其化合物在工业上有许多用途.以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
回答下列问题:
(1)写出Mg2B2O5•H2O与硫酸反应的化学方程式Mg2B2O5•H2O+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2H3BO3+2MgSO4.为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有提高反应温度或减小铁硼矿粉粒径(写出两条).
(2)“净化除杂”需先加H2O2溶液,作用是将亚铁离子氧化为铁离子.然后再调节溶液的pH约为5,目的是使铁离子、铝离子形成氢氧化物沉淀而除去.
(3)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为
 .
.(4)单质硼可用于生产具有优良抗冲击性能硼钢.以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O、B2O3+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO.
分析 以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3),由流程可知,加硫酸溶解Fe3O4、SiO2不溶,CaO转化为微溶于水的CaSO4,“净化除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,调节溶液的pH约为5,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3,以此来解答.
解答 解:(1)Mg2B2O5•H2O与硫酸反应的化学方程式Mg2B2O5•H2O+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2H3BO3+2MgSO4,为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有提高反应温度或减小铁硼矿粉粒径等,故答案为:Mg2B2O5•H2O+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2H3BO3+2MgSO4;提高反应温度或减小铁硼矿粉粒径;
(2)“净化除杂”需先加H2O2溶液,作用是将亚铁离子氧化为铁离子.然后在调节溶液的pH约为5,目的是使铁离子、铝离子形成氢氧化物沉淀而除去,
故答案为:将亚铁离子氧化为铁离子;使铁离子、铝离子形成氢氧化物沉淀而除去;
(3)NaBH4为离子化合物,含离子键、共价键,其电子式为 ,故答案为:
,故答案为: ;
;
(4)以硼酸和金属镁为原料可制备单质硼的化学方程式为2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O、B2O3+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO,
故答案为:2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O、B2O3+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO.
点评 本题考查混合物分离提纯的综合应用,为高频考点,为2015年高考真题,把握实验流程及发生的反应、混合物分离提纯方法为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案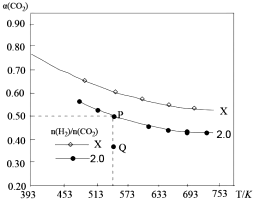 在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 氢碳比为2.0时.Q点v(H2)逆小于P点的v(H2)逆 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4•H2O,再次平衡后a(CO2)减小 |
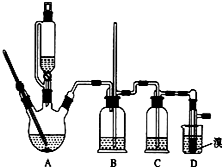 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
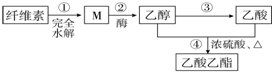
下列说法正确的是( )
| A. | ③和④都发生了氧化还原反应 | |
| B. | M虽然分子结构中无醛基,但仍然可以发生银镜反应 | |
| C. | 步骤②,1molM完全反应可以生成3mol乙醇 | |
| D. | 若用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯 |
①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯.
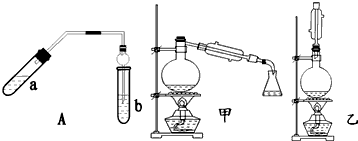
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是防止倒吸;步骤⑤中分离乙酸乙酯必须使用的一种仪器是分液漏斗.
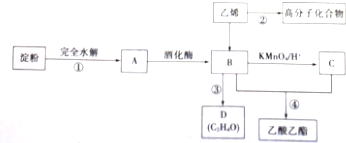
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图A所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管b再测有机层的厚度,实验记录如表:
| 实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层 的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应.
④为充分利用反应物,该同学又设计了图中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为更合理的是乙.理由是:乙装置能将易挥发的反应物乙酸和乙醇冷凝回流到反应容器中,继续反应,提高了乙酸、乙醇原料的利用率及产物的产率,而甲不可.
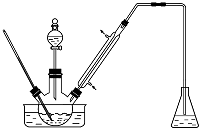 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见如图,相关物质的沸点见附表)其实验步骤为:
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见如图,相关物质的沸点见附表)其实验步骤为: