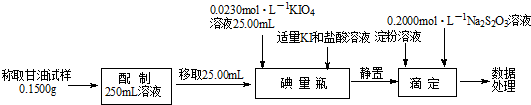
题目内容
14.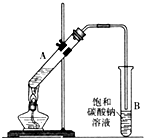 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
C2H5OH+C2H5OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6mL乙醇、4mL乙酸和4mL浓硫酸,这三种试剂的添加顺序依次为乙醇、浓硫酸、乙酸
(2)试管B中导管接近液面未伸入液面下的理由是防止发生倒吸
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77.1℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生大量的酸性废液污染环境,有副反应发生
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释:CH3COOH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
分析 (1)浓硫酸密度大,稀释产生大量的热,混合时应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;
(2)乙醇、乙酸易溶于水,试管受热不均匀,导管要插在饱和碳酸钠溶液的液面上,伸入液面下会发生倒吸;
(3)分离两种相互不溶解的液体应选择分液法;再用无水硫酸钠除去乙酸乙酯中的水,最后蒸馏可得纯净的乙酸乙酯,依据图中数据可知乙酸乙酯沸点;
(4)乙酸乙酯的实验室制备中反应需要浓硫酸作催化剂,产生酸性废水,同时乙醇发生副反应;
(5)白酒中的乙醇和醋中的乙酸发生酯化反应,生成乙酸乙酯和水,使菜肴昧香可口.
解答 解:(1)浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;添加顺序依次乙醇、浓硫酸、乙酸;
故答案为:乙醇、浓硫酸、乙酸;
(2)乙醇、乙酸易溶于水且试管受热不均,试管乙中的导管伸入液面下可能发生倒吸,导管不能插入液面下的原因是防止倒吸;
故答案为:防止倒吸;
(3)①乙酰乙酸乙酯难溶于水,可使生成的有机物分层,可用分液漏斗通过分液操作分离;
故答案为:分液;
②无水硫酸钠固体具有吸水的作用,
故答案为:干燥水分;
③由乙酸乙酯的沸点可知要搜集77.10C的液体;
故答案为:77.1;
(4)反应需要浓硫酸作催化剂,产生酸性废水,同时乙醇发生副反应;
故答案为:产生酸性废水,污染环境,同时发生副反应;
(5)白酒中的乙醇和醋中的乙酸发生酯化反应,生成乙酸乙酯和水,使菜肴昧香可口,反应方程式:CH3COOH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
故答案为:CH3COOH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
点评 本题考查了酯化反应,掌握混合物的分离和提纯方法,明确实验的实验原理是解答该题的关键,题目难度不大.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案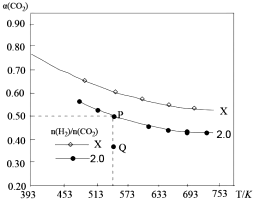 在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 氢碳比为2.0时.Q点v(H2)逆小于P点的v(H2)逆 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4•H2O,再次平衡后a(CO2)减小 |
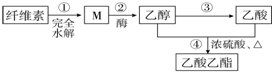
下列说法正确的是( )
| A. | ③和④都发生了氧化还原反应 | |
| B. | M虽然分子结构中无醛基,但仍然可以发生银镜反应 | |
| C. | 步骤②,1molM完全反应可以生成3mol乙醇 | |
| D. | 若用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯 |
①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯.
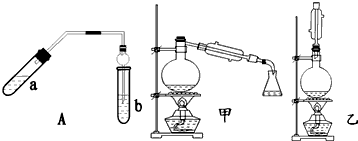
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是防止倒吸;步骤⑤中分离乙酸乙酯必须使用的一种仪器是分液漏斗.
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图A所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管b再测有机层的厚度,实验记录如表:
| 实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层 的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应.
④为充分利用反应物,该同学又设计了图中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为更合理的是乙.理由是:乙装置能将易挥发的反应物乙酸和乙醇冷凝回流到反应容器中,继续反应,提高了乙酸、乙醇原料的利用率及产物的产率,而甲不可.
| A. | 1分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1 mol H2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJ | |
| C. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJ | |
| D. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)吸收的热量为184.6 kJ |
 2SO3(g) ΔH<0。2 min后生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g) ΔH<0。2 min后生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是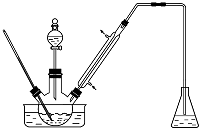 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见如图,相关物质的沸点见附表)其实验步骤为:
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见如图,相关物质的沸点见附表)其实验步骤为: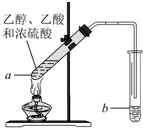 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.