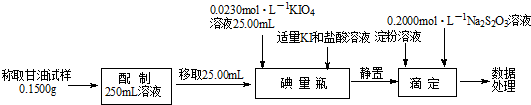
题目内容
13. 乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
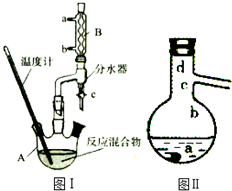
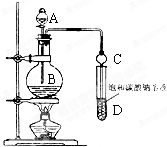
乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:Ⅰ.将混合液(18.5mL正丁醇和13.4mL乙酸(过量),0.4mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟.
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤.
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1g乙酸正丁酯.
部分实验数据如表所示:
| 化合物 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 溶解度(g)/(100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 乙酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 1 1 6 | 0.882 | 126.1 | 0.7 |
(2)步骤Ⅱ中的操作顺序为①③①②(填序号),用Na2CO3溶液洗涤的目的是除去残留在产品中的酸,试剂X不能选用下列物质中的b(填字母序号).
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示).
①蒸馏过程中需要使用直形冷凝管,当仪器连接好后,
a.向相应的冷凝管中通冷凝水;
b.加热蒸馏烧瓶的先后顺序是先a后b.(填“先a后b“或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的a、b(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质.
(4)该实验乙酸正丁酯的产率是74%(计算结果保留2位有效数字).
分析 (1)由装置图可知仪器A的名称是三颈烧瓶,根据酯化反应为可逆反应,减小生成物浓度,平衡正向移动分析;
(2)首先用水除去大部分可溶于水的硫酸等杂质,再用Na2C03溶液除去残留的酸,再用水除去残留在产品中的Na2C03溶液,残留的水再用于燥剂除去;根据Ca0吸水后生成碱会导致酯水解判断;
(3)①直形冷凝管能使液化产品能全部顺利地进入接收器中;为确保蒸馏产物全部液化,应先向冷凝管中通冷却水;
②同一烧瓶中,反应液的温度高于气体温度,蒸气温度从下向上温度逐渐降低,据此分析;
(4)先根据正丁醇的量计算理论上酯的量,再实际上酯的量与理论值之比即为酯的产率.
解答 解:(1)由装置图可知仪器A的名称是三颈烧瓶,将水分离出来,使产物中水的浓度减小,有利于酯化反应向右进行,所以使用分水器(实验中可分离出水)能提高酯的产率,故答案为:三颈烧瓶;不断分离出水,使容器内H2O浓度变小,有利于平衡向酯化反应方向移动;
(2)首先用水除去大部分可溶于水的硫酸等杂质,再用Na2C03溶液除去残留的酸,再用水除去残留在产品中的Na2C03溶液,残留的水再用于燥剂除去,所以步骤Ⅱ中的操作顺序为①③①②;因Ca0吸水后生成碱会导致酯水解,故不宜用Ca0作干燥剂,所以选b;故答案为:①③①②;除去残留在产品中的酸;b;
(3)①为使液化产品能全部顺利地进入接收器中,应使用直形冷凝管;为确保蒸馏产物全部液化,应先向冷凝管中通冷却水,然后加热烧瓶使温度迅速升温到沸点,所以先后顺序是先a后b;故答案为:直;先a后b;
②同一烧瓶中,反应液的温度高于气体温度,蒸气温度从下向上温度逐渐降低,故当温度计的水银球低于蒸馏烧瓶的支管口处时,会有较多沸点较低的物质夹杂在酯蒸气中,所以位于图Ⅱ中的a、b,故答案为:a、b;
(4)18.5mL正丁醇的质量是18.5 mL×0.8 g/mL=14.8 g,设理论上得到乙酸正丁酯的质量是x,
CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
74 9 116 g
14.8 g x
所以x=116 g×14.8 g÷74 g=23.2 g
生成乙酸正丁酯的产率是:17.1 g÷23.2 g×100%=74%,故答案为:74%.
点评 本题制备方案的设计,题目难度中等,明确乙酸正丁酯的制备原理以及运用原理理解实验装置是解答的关键,注意掌握制备方案设计与评价的原则,试题充分培养了学生的分析、理解能力及灵活应用所学知识的能力.

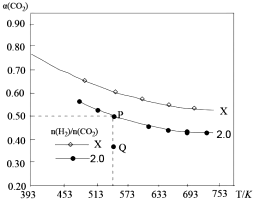 在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 氢碳比为2.0时.Q点v(H2)逆小于P点的v(H2)逆 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4•H2O,再次平衡后a(CO2)减小 |
 ,能在溶液中大量共存的是
,能在溶液中大量共存的是 2SO3(g) ΔH<0。2 min后生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g) ΔH<0。2 min后生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是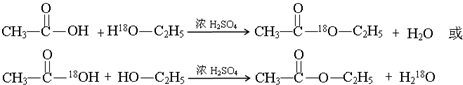 ;
;
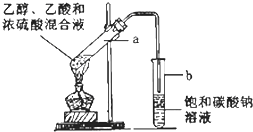 如图为实验室制取乙酸乙酯的装置.请回答:
如图为实验室制取乙酸乙酯的装置.请回答: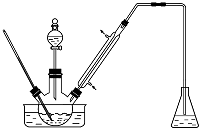 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见如图,相关物质的沸点见附表)其实验步骤为:
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见如图,相关物质的沸点见附表)其实验步骤为: