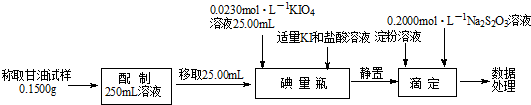
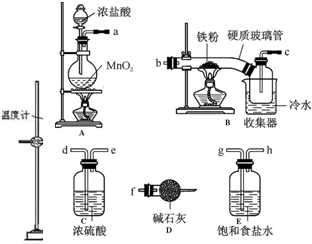
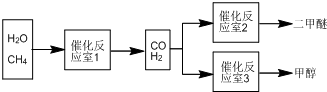
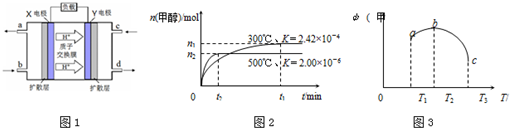
题目内容
15.下列热化学方程式叙述正确的是( )| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol (燃烧热) | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol (反应热) | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
分析 A.生成气态水不是稳定氧化物;
B.能量低的物质更稳定;
C.热化学方程式中注明物质的状态,焓变的数字、单位、正负号;
D.C的燃烧反应为放热反应,完全燃烧放出的热量多,但焓变为负.
解答 解:A.生成气态水不是稳定氧化物,则燃烧热的热化学方程式为C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367.0 kJ/mol,故A错误;
B.能量低的物质更稳定,由△H>0,可知石墨能量低,则石墨稳定,故B错误;
C.热化学方程式中注明物质的状态,焓变的数字、单位、正负号,则S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol (反应热)合理,故C正确;
D.C的燃烧反应为放热反应,完全燃烧放出的热量多,但焓变为负,由2C(s)+2O2(g)═2CO2(g)△H1、2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、燃烧热、热化学方程式书写为解答的关键,侧重分析与应用能力的考查,注意焓变的判断,题目难度不大.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
5.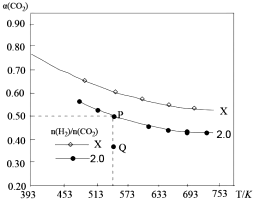 在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
 在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 氢碳比为2.0时.Q点v(H2)逆小于P点的v(H2)逆 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4•H2O,再次平衡后a(CO2)减小 |
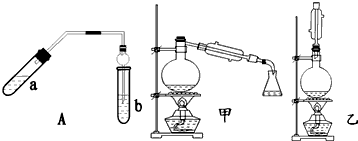
6.实验室制乙酸乙酯得主要装置如图中A所示,主要步骤:
①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯.
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是防止倒吸;步骤⑤中分离乙酸乙酯必须使用的一种仪器是分液漏斗.
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图A所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管b再测有机层的厚度,实验记录如表:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol•L-1.
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应.
④为充分利用反应物,该同学又设计了图中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为更合理的是乙.理由是:乙装置能将易挥发的反应物乙酸和乙醇冷凝回流到反应容器中,继续反应,提高了乙酸、乙醇原料的利用率及产物的产率,而甲不可.
①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯.

请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是防止倒吸;步骤⑤中分离乙酸乙酯必须使用的一种仪器是分液漏斗.
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图A所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管b再测有机层的厚度,实验记录如表:
| 实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层 的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应.
④为充分利用反应物,该同学又设计了图中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为更合理的是乙.理由是:乙装置能将易挥发的反应物乙酸和乙醇冷凝回流到反应容器中,继续反应,提高了乙酸、乙醇原料的利用率及产物的产率,而甲不可.
4.下列对H2(g)+Cl2(g)=2HCl(g)△H(298K)=-184.6kJ•mol-1的叙述正确的是( )
| A. | 1分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1 mol H2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJ | |
| C. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJ | |
| D. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)吸收的热量为184.6 kJ |
5.2016年环境日主题为“改善环境质量 推动绿色发展”,旨在动员引导社会各界着力践行人与自然和谐共生和绿色发展理念,从身边小事做起,共同履行环保责任,呵护环境质量,共建美丽家园.下列有关说法不正确的是( )
| A. | 开发废旧电池综合利用技术,防止重金属盐对土壤水资源造成污染 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 倡导低碳生活,使用太阳能、风能等代替化石燃料,可减少温室气体的排放 | |
| D. | 垃圾是放错地方的资源,应分类回收利用 |