题目内容
11.短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )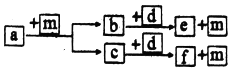
| A. | 简单离子半径:Z<Y | B. | 非金属性:X>Y | ||
| C. | 简单气态氢化物的热稳定性:Y>X | D. | W2Y2中含有共价键 |
分析 短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,d为Na2O2,m 为元素 Y 的单质,通常为无色无味的气体m为O2,则Y为O,a为烃,b、c分别为CO2、H2O,e、f分别为NaOH、碳酸钠,结合原子序数可知,W为H,X为C,Y为O,Z为Na,以此解答该题.
解答 解:由上述分析可知,W为H,X为C,Y为O,Z为Na,a为烃、b、c分别为CO2、H2O,e、f分别为NaOH、碳酸钠,
A.Z、Y的离子具有相同电子层结构,原子序数大的离子半径小,则简单离子半径:Z<Y,故A正确;
B.X为C,Y为O,同周期元素从左到右元素的非金属性逐渐增强,故B错误;
C.非金属性越强,对应氢化物越稳定,则简单气态氢化物的热稳定性:Y>X,故C正确;
D.H2O2 为共价化合物,含有共价键,故D正确;
故选B.
点评 本题考查无机物的推断,为高频考点,侧重分析与推断能力的考查,把握钠的化合物的性质及相互转化为解答的关键,注意淡黄色固体、原子序数为推断的突破口,题目难度不大.

练习册系列答案
相关题目
2.某固体化合物的化学式NH5,它的所有原子的最外层都符合稀有气体原子的电子层结构,则下列说法中,正确的是( )
| A. | 它与足量的水反应的化学方程式为:NH5+H2O═NH3•H2O+H2↑ | |
| B. | NH5中只有极性共价键的共价化合物 | |
| C. | 1molNH5中含有5NA个N-H键(NA表示阿伏伽德罗常数) | |
| D. | NH5中所有原子最外层均为8个电子 |
6.下列关于苯的叙述正确的是( )
| A. | 不能和氢气反应 | B. | 属于不饱和烃 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 含有碳碳双键 |
16.下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 同主族元素的最外层电子数相同 | 同主族元素的化学性质一定相似 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | S的非金属性比Si强 | 酸性:H2SO4>H4SiO4 |
| D | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
| A. | A | B. | B | C. | C | D. | D |
3.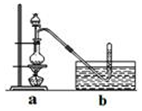 CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.
Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓)$→_{△}^{ZnCl_{2}}$ CH3Cl+H2O.具体步骤如下:
①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集.
请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是在干燥的HCl气氛中加热
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是增大盐酸的量以提高甲醇的转化率.
(3)实验室为何用排水法收集CH3Cl?CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体
Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化.现有四只洗气瓶;分别盛有以下试剂:
A.1.5%KMnO4(H+)溶液; B.蒸馏水;C.5%Na2SO3溶液; D.98%H2SO4
(1)为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶BAC (填洗气瓶编号),如果观察到A紫色褪去 则证实上述资料的正确性.
(2)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):10CH3Cl+14MnO4-+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32-+Cl2+H2O=SO42-+2Cl-+H+
(3)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛乙醇 的洗气瓶.
(4)某小组同学取VmL被CH3Cl污染的水样与锥形瓶中,用0.10mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如表所示:
第一次实验数据出现异常,造成这种异常的原因可能是bd (填字母代号).
a.锥形瓶洗净后未干燥 b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定过程中振荡锥形瓶时有液体溅出 d.滴定终点时仰视读数.
 CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓)$→_{△}^{ZnCl_{2}}$ CH3Cl+H2O.具体步骤如下:
①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集.
请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是在干燥的HCl气氛中加热
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是增大盐酸的量以提高甲醇的转化率.
(3)实验室为何用排水法收集CH3Cl?CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体
Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化.现有四只洗气瓶;分别盛有以下试剂:
A.1.5%KMnO4(H+)溶液; B.蒸馏水;C.5%Na2SO3溶液; D.98%H2SO4
(1)为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶BAC (填洗气瓶编号),如果观察到A紫色褪去 则证实上述资料的正确性.
(2)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):10CH3Cl+14MnO4-+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32-+Cl2+H2O=SO42-+2Cl-+H+
(3)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛乙醇 的洗气瓶.
(4)某小组同学取VmL被CH3Cl污染的水样与锥形瓶中,用0.10mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.90 | 20.02 | 20.00 | 19.98 |
a.锥形瓶洗净后未干燥 b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定过程中振荡锥形瓶时有液体溅出 d.滴定终点时仰视读数.
1. X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )| A. | X、Y对应的氧化物都是酸性氧化物 | |
| B. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| C. | Z比Y更容易与氢气化合 | |
| D. | W、Z对应的最高价氧化物对应的水化物的相对分子质量相等 |
