题目内容
4.海水经蒸发后获得大量的粗盐,这些粗盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验模拟工业生产精制食盐的流程如图所示: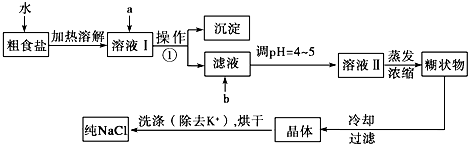
已知:①试剂a加入的顺序依次为:BaCl2溶液、NaOH溶液、饱和Na2CO3溶液
②常温下,NaCl在75%乙醇溶液中溶解度远小于KCl在75%乙醇溶液中溶解度
(1)最后加入饱和Na2CO3溶液的目的是在除去溶液中的Ca2+时,同时除去过量的Ba2+.
(2)操作①的名称是过滤,需要用到的玻璃仪器有漏斗玻璃棒烧杯.
(3)试剂b是稀盐酸(填名称).
(4)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为75%乙醇溶液,选用该试剂的目的是除去氯化钠晶体表面的氯化钾杂质,减少氯化钠晶体的损耗.
(5)简述检验NaCl晶体中不含有KCl杂质的实验操作为用洁净的铂丝蘸取少量固体,放置酒精灯火焰灼烧,透过蓝色钴玻璃若无紫色火焰,则证明不含KCl.
分析 (1)由于过程中加入过量的氯化钡溶液时引入了钡离子,溶液中还有钙离子没出去,故最后加入饱和Na2CO3溶液的目的是在除去溶液中的Ca2+时,同时除去过量的Ba2+;
(2)操作①为过滤,需要用到漏斗、烧杯、玻璃棒;
(3)加入试剂b是为了出去溶液中的氢氧根、碳酸根离子;
(4)洗涤除去NaCl晶体表面附带的少量KCl,用水洗会造成溶质损失,为减少氯化钠晶体的损耗,用75%乙醇溶液洗涤;
(5)检验NaCl晶体中不含有KCl杂质,用焰色反应检验.
解答 解:(1)由于过程中加入过量的氯化钡溶液时引入了钡离子,溶液中还有钙离子没出去,故最后加入饱和Na2CO3溶液的目的是在除去溶液中的Ca2+时,同时除去过量的Ba2+,故答案为:在除去溶液中的Ca2+时,同时除去过量的Ba2+;
(2)操作①为过滤除去不溶性杂质,需要用到漏斗、烧杯、玻璃棒,故答案为:过滤;漏斗、玻璃棒、烧杯;
(3)加入试剂b是为了出去溶液中的氢氧根、碳酸根离子,故需加入稀盐酸,故答案为:稀盐酸;
(4)洗涤除去NaCl晶体表面附带的少量KCl,用水洗会造成溶质损失,为减少氯化钠晶体的损耗,用75%乙醇溶液洗涤,故答案为:75%乙醇溶液;除去氯化钠晶体表面的氯化钾杂质,减少氯化钠晶体的损耗;
(5)检验NaCl晶体中不含有KCl杂质,用焰色反应检验,方法为用洁净的铂丝蘸取少量固体,放置酒精灯火焰灼烧,透过蓝色钴玻璃若无紫色火焰,则证明不含KCl,故答案为:用洁净的铂丝蘸取少量固体,放置酒精灯火焰灼烧,透过蓝色钴玻璃若无紫色火焰,则证明不含KCl.
点评 本题考查海水资源综合应用,为高频考点,涉及流程分析及混合物分离提纯等,把握发生的反应及物质性质为解答的关键,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
3.四氯化碳是生产金属钛及其化合物的重要中间体,实验窒利用反应:TiO2(s)+2CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),制取TiCl4,实验装置如图所示: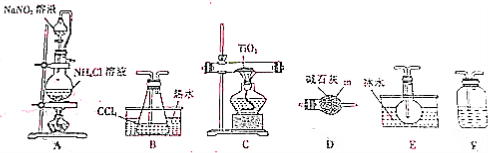
有关物质的性质如下表:
回答下列问题:
(1)仪器m的名称为球形干燥管.
(2)装置A中有氮气生成,该反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O
(3)实验装置依次连接的顺序为A→F→B→C→E→D.装置F中盛有的物质是浓硫酸(4)装置D的作用是防止外界的水汽进入TiCl4收集装置里.
(5)欲分离装置E中态混合采用操作的名称是蒸馏.
(6)反应结束前进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温,正确的操作顺序②③①
(7)利用反应:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),也可以制取TiCl4,除了在上述实验装置中将装置A改为氯气的发生装置,撤去装置B之外,请件数对其他装置的改变:石英管内改为盛TiO2和C.

有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,加热时能被氧气氧化 |
(1)仪器m的名称为球形干燥管.
(2)装置A中有氮气生成,该反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O
(3)实验装置依次连接的顺序为A→F→B→C→E→D.装置F中盛有的物质是浓硫酸(4)装置D的作用是防止外界的水汽进入TiCl4收集装置里.
(5)欲分离装置E中态混合采用操作的名称是蒸馏.
(6)反应结束前进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温,正确的操作顺序②③①
(7)利用反应:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),也可以制取TiCl4,除了在上述实验装置中将装置A改为氯气的发生装置,撤去装置B之外,请件数对其他装置的改变:石英管内改为盛TiO2和C.
4.霉酚酸是一种生物活性化合物,其结构如下图所示.下列有关霉酚酸的说法正确的是( )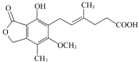

| A. | 该物质的分子式为C17H18O6 | |
| B. | 该物质中含有四种官能团 | |
| C. | 1 mol该物质可与4 mol Br2发生加成反应 | |
| D. | 1 mol该物质与足量金属钠反应产生1 mol氢气 |
1.下列各组物质,互为同位素的是( )
| A. | 11H2和21H2 | B. | H2O和D2O | C. | 235U 和 238U | D. | O2和O3 |
8.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 一定量的Na与O2完全反应生成1mol产物时,转移电子数为2NA | |
| B. | 23g乙醇与足量金属钠完全反应时,可生成5.6L氢气 | |
| C. | 1molHCl气体与1molNH3完全反应时,可生成NA个NH4Cl分子 | |
| D. | 若1molCH4与1molCl2光照下充分反应,则生成的一氯甲烷分子的数目为NA |
14.归纳整理是科学学习的重要方法之一.氧族元素的部分性质归纳整理如下:
请根据上表数据以及数据变化趋势,回答下列问题:
(1)硒的熔点范围可能是:113℃~450℃
(2)碲(Te)可能的化合价有:-2,+4,+6
(3)硒(Se)的原子半径可能在0.102~0.136之间.
(4)从单质与氢化合的难易程度可以推测出,O、S、Se、Te的非金属性逐渐减弱(增强、减弱).
元素 性质 | 8O | 16S | 34Se | 52Te |
| 单质熔点/℃ | -218,4 | 113 | ? | 450 |
| 单质沸点/℃ | -183 | 444.6 | 685 | 989 |
| 主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | ? |
| 原子半径/nm | 0.074 | 0.102 | ? | 0.136 |
| 单质与氢化合的难易程度 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接 |
(1)硒的熔点范围可能是:113℃~450℃
(2)碲(Te)可能的化合价有:-2,+4,+6
(3)硒(Se)的原子半径可能在0.102~0.136之间.
(4)从单质与氢化合的难易程度可以推测出,O、S、Se、Te的非金属性逐渐减弱(增强、减弱).
 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.