题目内容
9.下列有关实验的结论或解释都正确的是( )| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 将某有机物滴入高锰酸钾溶液中 | 高锰酸钾溶液褪色 | 该有机物一定含不饱和键 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 向某淡黄色试液X中滴加少许NaOH溶液 | 试液X中出现红褐色沉淀 | 说明试液X中一定含有FeCl3 |
| D | 向装有少许无水硫酸铜的试管中加入乙醇 | 固体由白变蓝 | 该乙醇中一定含有水 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.烯烃、炔烃、醇、醛、酚等均能被高锰酸钾氧化;
B.常温下将Al片放入浓硝酸中,发生钝化;
C.红褐色沉淀为氢氧化铁;
D.无水硫酸铜遇水变蓝.
解答 解:A.由高锰酸钾溶液褪色,可知有机物具有还原性,若为乙醇,不含不饱和键,故A错误;
B.常温下将Al片放入浓硝酸中,发生钝化,生成致密的氧化膜阻止反应的进一步发生,故B错误;
C.由试液X中出现红褐色沉淀,红褐色沉淀为氢氧化铁,则溶液中含铁离子,可能FeCl3或硫酸铁等,故C错误;
D.无水硫酸铜遇水变蓝,由现象可知,该乙醇中一定含有水,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,选项C为解答的易错点,题目难度不大.

练习册系列答案
相关题目
19. (1)向含有等物质的量的SO32-、Fe2+、Br-、I-的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系如图所示.
(1)向含有等物质的量的SO32-、Fe2+、Br-、I-的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系如图所示.
①原溶液中各离子的物质的量是0.1mol
②通入C123.36L时,溶液中发生反应的离子方程式有SO32-+Cl2+H2O=SO42-+2Cl-+2H+、2I-+Cl2=I2+2Cl-.
(2)某溶液中仅含如表中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均为0.01mol.
a若向溶液中加入KSCN溶液,无明显变化
b若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变
c若向溶液中加入BaCl2溶液,有白色沉淀生成.
试回答下列问题:
①原溶液中所含的阴离子是NO3-、Cl-、SO42-;
②若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体是CuO、Fe2O3(写化学式);
③若向原溶液中加入过量盐酸,写出该过程中发生反应的离子方程式3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
 (1)向含有等物质的量的SO32-、Fe2+、Br-、I-的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系如图所示.
(1)向含有等物质的量的SO32-、Fe2+、Br-、I-的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系如图所示.①原溶液中各离子的物质的量是0.1mol
②通入C123.36L时,溶液中发生反应的离子方程式有SO32-+Cl2+H2O=SO42-+2Cl-+2H+、2I-+Cl2=I2+2Cl-.
(2)某溶液中仅含如表中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均为0.01mol.
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
b若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变
c若向溶液中加入BaCl2溶液,有白色沉淀生成.
试回答下列问题:
①原溶液中所含的阴离子是NO3-、Cl-、SO42-;
②若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体是CuO、Fe2O3(写化学式);
③若向原溶液中加入过量盐酸,写出该过程中发生反应的离子方程式3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
20.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
| A. | 将 SO2通入水中 | B. | 烧碱溶于水 | C. | 将 HCl 通入水中 | D. | NaHSO4溶于水中 |
17.下列有关化学用语正确的是( )
| A. | 核内有 8 个中子的碳原子:68C | B. | 羰基硫(COS)的结构式: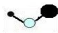 | ||
| C. | 乙烯的比例模型: | D. | NH4Br 的电子式: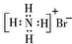 |
14.下列溶液中溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将58.5gNaC1溶解于1L水中配成的溶液 | |
| B. | 将80gSO3溶于水并配成1L溶液 | |
| C. | 将100mI.0.5mol•L-1NaNO3溶液加热蒸发掉50g水之后的溶液 | |
| D. | 含2molK+的K2SO4溶液 |
1.在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是( )
| A. | SiO2、N2O5、CO、Cl2 | B. | Al2O3、Cl2、N2O5、SO3 | ||
| C. | CO2、Al(OH)3、CaO、SO2 | D. | Al2O3、CO2、SO3、SO2 |
 H2SO3+2OH-
H2SO3+2OH- ,它可通过不同化学反应分别制得B、C、D三种物质.
,它可通过不同化学反应分别制得B、C、D三种物质.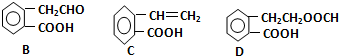
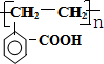 .
. .
.