题目内容
9.室温时,0.01mol•L-1HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,下列有关叙述正确的是( )| A. | 原HA溶液中,c(H+)=c(A-) | |
| B. | 当恰好完全中和时,溶液呈中性 | |
| C. | 当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当滴入少量的NaOH,促进了HA的电离,溶液的pH升高 |
分析 A.根据电荷守恒分析;
B.0.01mol•L-1HA溶液的pH=3,说明HA为弱酸,酸碱恰好反应生成强碱弱酸盐;
C.根据电荷守恒分析;
D.氢氧化钠会消耗氢离子,氢离子浓度减小,HA的电离平衡正移.
解答 解:A.原HA溶液中,存在电荷守恒:c(H+)=c(A-)+c(OH-),所以c(H+)<c(A-),故A错误;
B.0.01mol•L-1HA溶液的pH=3,说明HA部分电离为弱酸,酸碱恰好反应生成强碱弱酸盐,所以NaA会发生水解显碱性,故B错误;
C.溶液中存在电荷守恒:c(A-)+c(OH-)=c(Na+)+c(H+),当c(A-)>c(Na+)时,则c(OH-)<c(H+),故C错误;
D.当滴入少量的NaOH,氢氧化钠会消耗氢离子,氢离子浓度减小,HA的电离平衡正移,促进了HA的电离,氢离子浓度减小,所以溶液的pH升高,故D正确.
故选D.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,涉及离子浓度大小比较、电荷守恒等知识,解题时注意电荷守恒及物料守恒的应用,明确溶液酸碱性与溶液pH的关系为解答关键.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
19.在含CH3COOH和CH3COONa均为0.1mol/L的溶液中,测得c(CH3COO-)>c(Na+)则下列关系式中正确的是( )
| A. | c(H+)>c(OH-) | B. | c(H+)<c(OH-) | ||
| C. | c(CH3COOH)>c( CH3COO-) | D. | c(CH3COOH)+c(CH3COO- )=0.2mol/L |
20.随着人民群众生活水平的提高,居窒的装饰,装修成为必需,研究表明,造成室内空气污染的主要元料、人造板、油漆、黏合剂等材料中的甲醛和苯酚等有机物,绝大多数这些有机物有致癌或促癌作用生命健康,有同学建议装修之后采取以下措施.你认为最适宜的是( )
| A. | 放一大盆水于室内 | B. | 放一大盆苯于室内加以溶解吸收 | ||
| C. | 洒一些酸性KMnO4溶液于地面 | D. | 打开窗户,长时间通风 |
17.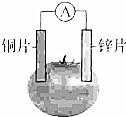 甲乙两位同学一起做水果电池的实验,测得数据如下:
甲乙两位同学一起做水果电池的实验,测得数据如下:
甲同学提出的问题,乙同学解释不正确的是( )
①甲:实验6中负极电极反应式如何写?
乙:铝为负极:Al-3e-=Al3+
②甲:实验1、5中电流方向为什么相反?
乙:实验1中锌比铜活泼,锌为负极,实验5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关?
乙:只跟水果的品种有关.
 甲乙两位同学一起做水果电池的实验,测得数据如下:
甲乙两位同学一起做水果电池的实验,测得数据如下:| 试验编号 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
| 1 | 锌 | 铜 | 菠萝 | 3 | 900 |
| 2 | 锌 | 铜 | 苹果 | 3 | 650 |
| 3 | 锌 | 铜 | 柑桔 | 3 | 850 |
| 4 | 锌 | 铜 | 西红柿 | 3 | 750 |
| 5 | 锌 | 铝 | 菠萝 | 3 | 650 |
| 6 | 锌 | 铝 | 苹果 | 3 | 450 |
①甲:实验6中负极电极反应式如何写?
乙:铝为负极:Al-3e-=Al3+
②甲:实验1、5中电流方向为什么相反?
乙:实验1中锌比铜活泼,锌为负极,实验5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关?
乙:只跟水果的品种有关.
| A. | ③ | B. | ① | C. | ①②③ | D. | ②③ |
14.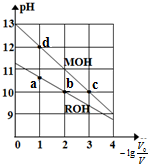 常温下,向体积均为V0、浓度均为0.10mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-lg$\frac{{v}_{0}}{v}$的变化如图所示,下列叙述正确的是( )
常温下,向体积均为V0、浓度均为0.10mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-lg$\frac{{v}_{0}}{v}$的变化如图所示,下列叙述正确的是( )
 常温下,向体积均为V0、浓度均为0.10mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-lg$\frac{{v}_{0}}{v}$的变化如图所示,下列叙述正确的是( )
常温下,向体积均为V0、浓度均为0.10mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-lg$\frac{{v}_{0}}{v}$的变化如图所示,下列叙述正确的是( )| A. | b、c两点的溶液中:c(R+)>c(M+) | |
| B. | MOH的电离程度:c点小于d点 | |
| C. | 溶液中水的电离程度:b>c>a>d | |
| D. | 当-lg$\frac{{v}_{0}}{v}$=2时,若两溶液同时升高温度,则$\frac{c({R}^{+})}{c({M}^{+})}$增大 |
19.下列表示对应化学反应的离子方程式正确的是( )
| A. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═=CaCO3↓+CO32-+2H2O | |
| B. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| C. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| D. | 酸性溶液中KlO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O |
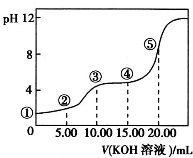
 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.