题目内容
19.在含CH3COOH和CH3COONa均为0.1mol/L的溶液中,测得c(CH3COO-)>c(Na+)则下列关系式中正确的是( )| A. | c(H+)>c(OH-) | B. | c(H+)<c(OH-) | ||
| C. | c(CH3COOH)>c( CH3COO-) | D. | c(CH3COOH)+c(CH3COO- )=0.2mol/L |
分析 A.从溶液电中性的角度分析;
B.从溶液电中性的角度分析;
C.CH3COOH和CH3COONa混合溶液,CH3COOH电离程度大于CH3COO-水解程度;
D.根据物料守恒判断.
解答 解:A.CH3COOH和CH3COONa混合溶液中,存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),已知c(CH3COO-)>c(Na+),则c(H+)>C(OH-),故A正确;
B.由A分析可知,c(H+)>C(OH-),故B错误;
C.CH3COOH和CH3COONa混合溶液,CH3COOH电离程度大于CH3COO-水解程度,则c(CH3COO-)>c(CH3COOH),故C错误;
D.在含CH3COOH和CH3COONa均为0.1mol/L的溶液中,c(CH3COOH)+c(CH3COO-)=0.2mol•L-1,故D正确.
故选AD.
点评 本题考查弱电解质的电离和盐类水解问题,题目难度中等,注意根据溶液电中性和物料守恒解答该题,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
7.某同学利用如图1装置探究温度对化学平衡的影响,已知烧瓶中存在如下平衡:2NO2?N2O4△H<0.当进行图2实验后,以下结论正确的是( )
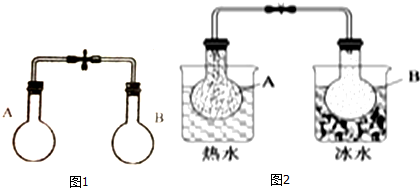

| A. | 图2中,B烧瓶颜色较深 | |
| B. | 图2中,B烧瓶与A烧瓶相比有较多的NO2 | |
| C. | 图2中B烧瓶的正反应速率比图1中B烧瓶的快 | |
| D. | 图2中A烧瓶的正反应速率比图1中A烧瓶的快 |
14.燃烧1g乙醇(液态)生成CO2气体和液态水放出热量为29.7KJ,则乙醇燃烧的热化学方程式正确的是( )
| A. | C2H 5OH+3O2═2CO2+3H 2O△H=-29.7 kJ/mol -1 | |
| B. | C2H 5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol -1 | |
| C. | C 2 H 5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol-1 | |
| D. | C2H 5OH(l)+3O2 (g)═2CO 2 (g)+3H 2 O(l)△H=-1366.2kJ/mol -1 |
4.为了鉴别乙烯、甲苯、苯酚溶液、乙醇溶液四种无色的液体,可以使用下列试剂合理的一组是( )
| A. | KMnO4酸性溶液 | B. | 银氨溶液 | ||
| C. | 溴水 | D. | 新制Cu(OH)2和FeCl3溶液 |
8.下列化学式能代表一种纯净物的是( )
| A. | C3H8 | B. | C4H10 | C. | C5H12 | D. | C2H4Br2 |
9.室温时,0.01mol•L-1HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,下列有关叙述正确的是( )
| A. | 原HA溶液中,c(H+)=c(A-) | |
| B. | 当恰好完全中和时,溶液呈中性 | |
| C. | 当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当滴入少量的NaOH,促进了HA的电离,溶液的pH升高 |
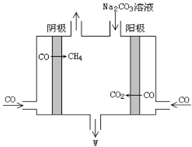 (1)利用CO2与H2反应可合成二甲醚(CH3OCH3).以KOH为电解质溶液,组成二甲醚--空气燃料电池,该电池工作时其负极反应式是CH3OCH3-12e-+16OH-=2CO32-+11H2O.
(1)利用CO2与H2反应可合成二甲醚(CH3OCH3).以KOH为电解质溶液,组成二甲醚--空气燃料电池,该电池工作时其负极反应式是CH3OCH3-12e-+16OH-=2CO32-+11H2O.