题目内容
19.下列表示对应化学反应的离子方程式正确的是( )| A. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═=CaCO3↓+CO32-+2H2O | |
| B. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| C. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| D. | 酸性溶液中KlO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O |
分析 A.二者反应生成碳酸钙和水;
B.二价铁离子具有强的还原性,容易被氧化生成三价铁离子;
C.硝酸具有强的氧化性,能够氧化亚硫酸根离子生成硫酸根离子;
D.根据酸性条件下不能生成氢氧根离子,原子守恒判断.
解答 解:A.过量石灰水与碳酸氢钙反应,离子方程式:Ca2++HCO3-+0H-═=CaC03↓+H2O,故A错误;
B.FeS04酸性溶液暴露在空气中,离子方程式:4Fe2++O2+4H+═Fe3++2H20,故B正确;
C.向稀HNO3中滴加Na2SO3溶液,离子方程式:2NO3-+3SO32-+2H+═3SO42-+2NO↑+H2O,故C错误;
D.酸性条件下不能生成氢氧根离子,原子得守恒,酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式:IO3-+5I-+6H+═3I2+3H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实,题目难度中等.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
9.室温时,0.01mol•L-1HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,下列有关叙述正确的是( )
| A. | 原HA溶液中,c(H+)=c(A-) | |
| B. | 当恰好完全中和时,溶液呈中性 | |
| C. | 当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当滴入少量的NaOH,促进了HA的电离,溶液的pH升高 |
14.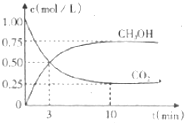 固定和利用C02.能存效地利用资源,并减少空气中的温室气体.工业上正在研究利用C02来生产甲醇燃料的方法,该方法的化学方程式是C02 (g)+3H2 (g)?CH30H (g)+H2O(g)△H=-49.0kJ/mol,在体积为1L的密闭容器中,充人1molCO2和4molH2,一定条件下发生反应:测得C02和CH30H(g)的浓度随时间变化如图所示.下列说法正确的是
固定和利用C02.能存效地利用资源,并减少空气中的温室气体.工业上正在研究利用C02来生产甲醇燃料的方法,该方法的化学方程式是C02 (g)+3H2 (g)?CH30H (g)+H2O(g)△H=-49.0kJ/mol,在体积为1L的密闭容器中,充人1molCO2和4molH2,一定条件下发生反应:测得C02和CH30H(g)的浓度随时间变化如图所示.下列说法正确的是
( )
 固定和利用C02.能存效地利用资源,并减少空气中的温室气体.工业上正在研究利用C02来生产甲醇燃料的方法,该方法的化学方程式是C02 (g)+3H2 (g)?CH30H (g)+H2O(g)△H=-49.0kJ/mol,在体积为1L的密闭容器中,充人1molCO2和4molH2,一定条件下发生反应:测得C02和CH30H(g)的浓度随时间变化如图所示.下列说法正确的是
固定和利用C02.能存效地利用资源,并减少空气中的温室气体.工业上正在研究利用C02来生产甲醇燃料的方法,该方法的化学方程式是C02 (g)+3H2 (g)?CH30H (g)+H2O(g)△H=-49.0kJ/mol,在体积为1L的密闭容器中,充人1molCO2和4molH2,一定条件下发生反应:测得C02和CH30H(g)的浓度随时间变化如图所示.下列说法正确的是( )
| A. | 该反应在高温条件下能向发进行 | |
| B. | 充人 He(g).能使 $\frac{n(C{H}_{3}OH)}{n(C{0}_{2})}$增大 | |
| C. | 再充入1molCO2和4molH2,能使$\frac{n(C{H}_{2}OH)}{n(C{O}_{2})}$增大 | |
| D. | 容器内气体密度不再改变说明该飞应达到平衡状态 |
4.甲与乙在敞口容器里的溶液中的转化关系如图所示,甲不可能是( )
甲$\stackrel{OH-}{→}$乙$\stackrel{H+}{→}$甲.
甲$\stackrel{OH-}{→}$乙$\stackrel{H+}{→}$甲.
| A. | Fe2+ | B. | Al | C. | HCO${\;}_{3}^{-}$ | D. | CO2 |
8.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. |  实验室制取乙烯 | B. | 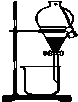 利用酒精萃取碘水中的I2单质 | ||
| C. | 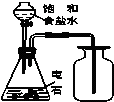 实验室制取乙炔并收集 | D. | 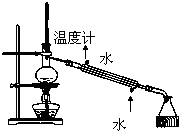 石油的分馏实验 |
9.CO是甲酸(HCOOH)的酸酐,将甲酸与下列某物质混合可制取CO,该物质是( )
| A. | 浓硫酸 | B. | 碳粉 | C. | NaOH固体 | D. | Na2O2粉末 |
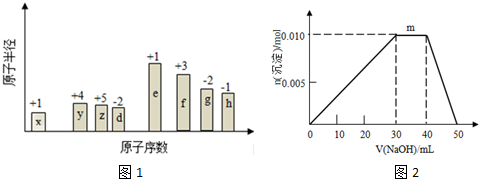
 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O. .
.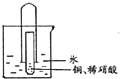 为了探究一氧化氮、二氧化氮、硝酸之间的相互转化,有同学设计了如下实验:如图将少量铜片装入小试管中,再加人适量稀硝酸,然后迅速将大试管倒扣在小试管外.将套好的大、小试管一起竖立在烧杯中,使水浸没大试管口.充分反应完后,通过弯玻璃管往大试管中吹人足量空气,并往烧杯中滴人几滴紫色石蕊试液.试回答:
为了探究一氧化氮、二氧化氮、硝酸之间的相互转化,有同学设计了如下实验:如图将少量铜片装入小试管中,再加人适量稀硝酸,然后迅速将大试管倒扣在小试管外.将套好的大、小试管一起竖立在烧杯中,使水浸没大试管口.充分反应完后,通过弯玻璃管往大试管中吹人足量空气,并往烧杯中滴人几滴紫色石蕊试液.试回答: