题目内容
17.下列有关铁及其化合物的有关说法中正确的是( )| A. | 铁红的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 | |
| D. | Fe3+与KSCN产生红色沉淀 |
分析 A.磁铁矿的主要成分是氧化铁,不是四氧化三铁;
B.铁与水蒸气在高温下反应生成四氧化三铁和氢气,生成的不是氧化铁;
C.亚铁离子能够被氯气氧化成铁离子,反应生成的阴离子为氯离子,没有引进杂质;
D.铁离子与硫氰化钾反应生成红色的络合物硫氰化铁,不是红色沉淀.
解答 解:A.氧化铁为红棕色的粉末,赤铁矿主要成分为Fe2O3,不是Fe3O4,故A错误;
B.铁与水蒸气反应生成的是Fe3O4和氢气,反应的化学方程式为:3Fe+4H2O(g)=Fe3O4+4H2,故B错误;
C.除去FeCl3溶液中的FeCl2杂质可以向溶液中通入适量氯气,氯化亚铁与氯气反应生成氯化铁,除去了杂质亚铁离子,故C正确;
D.铁离子与硫氰根离子反应生成的硫氰化铁不是沉淀,是一种红色的络合物,故D错误;
故选C.
点评 本题考查了铁及其氧化物达到性质,题目难度不大,试题注重了基础知识的考查,注意掌握铁及其氧化物的组成、性质,明确氧化铁与四氧化三铁的性质区别.

练习册系列答案
相关题目
7.将80℃饱和KNO3溶液冷却至10℃,有KNO3固体析出.该过程中保持不变的是( )
| A. | 溶剂的质量 | B. | 溶质的质量分数 | C. | KNO3的溶解度 | D. | 溶液中K+的数目 |
8.下列有关σ键和π键的说法错误的是( )
| A. | 在某些分子中,化学键可能只有σ键而没有π键 | |
| B. | 分子中σ键的键能一定大于π键的键能 | |
| C. | σ键的特征是轴对称,π键的特征是镜面对称 | |
| D. | SO2形成π键与O3的π键是相似的 |
5.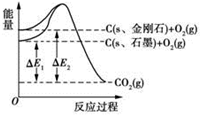 2013年7月23日人民网报道,河南省柘城县科技创新“创”出金刚石产业新天地.1mol石墨在一定条件下完全转化为金刚石,其能量变化如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )
2013年7月23日人民网报道,河南省柘城县科技创新“创”出金刚石产业新天地.1mol石墨在一定条件下完全转化为金刚石,其能量变化如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )
 2013年7月23日人民网报道,河南省柘城县科技创新“创”出金刚石产业新天地.1mol石墨在一定条件下完全转化为金刚石,其能量变化如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )
2013年7月23日人民网报道,河南省柘城县科技创新“创”出金刚石产业新天地.1mol石墨在一定条件下完全转化为金刚石,其能量变化如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )| A. | 1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量 | |
| B. | 石墨转化为金刚石属于物理变化 | |
| C. | 金刚石的稳定性强于石墨的 | |
| D. | 1 mol金刚石的能量大于1mol CO2的能量 |
2.根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A. | 硒(Se)化氢比硫化氢稳定 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强 |
9.对下列物质的类別与所含官能团判断中,不正确的是( )
| A. | 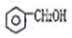 醇类-OH 醇类-OH | B. | CH3CH2COOH 羧酸类-COOH | ||
| C. | 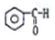 酮类-CHO 酮类-CHO | D. | CH3CH2Br 卤代烃类-Br |
15.滴定实验是化学学科中重要的定量实验.
已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
请回答下列问题:
(1)滴定终点时的现象是浅红色变为无色,30S不变色.
(2)所配制的250mL样品液中NaOH的物质的量浓度是0.08 mol•L-1;试样中NaOH的质量分数为80%.
(3)若出现下列情况,测定结果偏高的是ce.
a.滴定前用蒸馏水冲洗锥形瓶
b.在摇动锥形瓶时不慎将瓶内溶液溅出
c.滴定前有气泡,滴定后气泡消失
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗.
已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
| 滴定序号[来源:学科网] | 待测液体积(mL) | 所消耗标准盐酸的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
(1)滴定终点时的现象是浅红色变为无色,30S不变色.
(2)所配制的250mL样品液中NaOH的物质的量浓度是0.08 mol•L-1;试样中NaOH的质量分数为80%.
(3)若出现下列情况,测定结果偏高的是ce.
a.滴定前用蒸馏水冲洗锥形瓶
b.在摇动锥形瓶时不慎将瓶内溶液溅出
c.滴定前有气泡,滴定后气泡消失
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗.
16.下列离子方程式正确的是( )
| A. | 向盐酸中加入适量氨水:H++OH-═H2O | |
| B. | 铁和稀硝酸反应:Fe+2H+═H2↑+Fe2+ | |
| C. | 在AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铜与浓HNO3反应:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑ |
 .
.