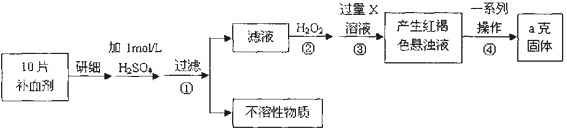
题目内容
2.根据元素周期表和元素周期律分析下面的推断,其中错误的是( )| A. | 硒(Se)化氢比硫化氢稳定 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强 |
分析 A.非金属性越强,对应氢化物越稳定;
B.AgCl不溶于硝酸,同主族元素化合物性质相似;
C.同主族从上到下金属性增强,金属性越强越易失去电子;
D.金属性越强,对应氢氧化物的碱性越强.
解答 解:A.非金属性S>Se,则硫化氢比硒(Se)化氢稳定,故A错误;
B.AgCl不溶于硝酸,同主族元素化合物性质相似,则砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸,故B正确;
C.同主族从上到下金属性增强,金属性越强越易失去电子,则铍(Be)的原子失电子能力比镁弱,故C正确;
D.金属性Sr>Ca,则氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强,故D正确;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素在周期表的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
相关题目
12.关于铝及其化合物的说法错误的是( )
| A. | 氧化铝是一种高硬度高熔沸点化合物 | |
| B. | 铝是活泼金属,其合金抗腐蚀能力差 | |
| C. | 常温下铝能与氧气反应 | |
| D. | 氢氧化铝能中和胃酸,可用于制胃药 |
13.根据有机化合物的命名原则,下列命名正确的是( )
| A. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | B. |  2-羟基丁烷 2-羟基丁烷 | ||
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | D. | CH3CHBrCH2CH3 2-溴丁烷 |
10.下列有关第ⅦA族元素说法中不正确的是( )
| A. | 原子最外层电子数都是7 | B. | 从F2到I2,氧化性逐渐增强 | ||
| C. | 从F2到I2,颜色逐渐加深 | D. | 熔、沸点:F2<Cl2<Br2<I2 |
17.下列有关铁及其化合物的有关说法中正确的是( )
| A. | 铁红的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 | |
| D. | Fe3+与KSCN产生红色沉淀 |
7.X、Y、Z、M、N、q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示.下列说法正确的是( )
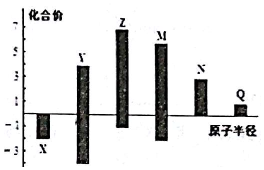

| A. | 金属性:N>Q | |
| B. | 最高价氧化物对应水化物酸性:M>Y>N | |
| C. | 简单离子半径:Q>N>X | |
| D. | 原子序数:Z>M>X>Y |
1.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯能发生加成反应,乙烷不能发生加成反应 |