题目内容
18.下列实验中制取气体的药品和装置图正确的是( )| A. |  制NH3 | B. |  制Cl2 | C. |  制乙酸乙酯 | D. |  制Fe(OH)2 |
分析 A.铵盐与碱加热可制备氨气,氨气的密度比空气的密度小,利用向下排空气法收集;
B.浓盐酸与二氧化锰反应需要加热;
C.试剂应为冰醋酸,且导管在碳酸钠溶液液体下可发生倒吸;
D.煤油的密度小,在上层可隔绝氧气.
解答 解:A.铵盐与碱加热可制备氨气,氨气的密度比空气的密度小,利用向下排空气法收集,图中装置可制备氨气,故A正确;
B.浓盐酸与二氧化锰反应需要加热,图中缺少酒精灯,故B错误;
C.试剂应为冰醋酸,且导管在碳酸钠溶液液体下可发生倒吸,则不能制备乙酸乙酯,故C错误;
D.煤油的密度小,在上层可隔绝氧气,图中装置可制备Fe(OH)2,故D正确;
故选AD.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质制备原理及装置为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列过程中吸收热量的是( )
| A. | 液氨气化 | B. | 酸城中和 | C. | 浓硫酸加水稀释 | D. | 镁条与盐酸反应 |
6.目前,CO、CO2的有效开发利用成为科学家研究的重要课题.
Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)?CH3OH(g)的△H=-90.1kJ•mol-1.
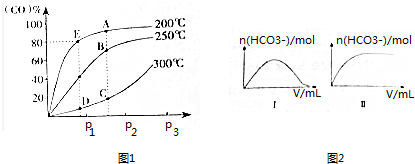
(2)将1molCO和2molH2充入密闭容器中发生上述反应.气体条件相同时,CO的平衡转化率[α(CO)]与压强(p)和温度(T)的关系如图1所示.
①A、B两点CH3OH的质量分数ω(A)>ω(B)(填“>”、“<”或“=”),理由为A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动.
②C、D两点的逆反应速率:v正(C)>v逆(D)(填“>”、“<”或“=”),理由为该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快.
③200℃时,测得E的容器容积为10L.该温度下,反应的平衡常数K=2500;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为0<x<58.
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景.T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,其它条件不变,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是B(填选项字母).
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g) C.加入催化剂 D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
已知:25℃时,几种酸的电离平衡常数如下表所示.
25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:①NaHC2O4②HNO3③HClO,溶液中的n(HCO3-)与所加入溶液体积(V)的关系如图2所示.其中,符合曲线Ⅰ的溶液为①②(填序号,下同);符合曲线Ⅱ的溶液为③.

Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)?CH3OH(g)的△H=-90.1kJ•mol-1.
(2)将1molCO和2molH2充入密闭容器中发生上述反应.气体条件相同时,CO的平衡转化率[α(CO)]与压强(p)和温度(T)的关系如图1所示.
①A、B两点CH3OH的质量分数ω(A)>ω(B)(填“>”、“<”或“=”),理由为A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动.
②C、D两点的逆反应速率:v正(C)>v逆(D)(填“>”、“<”或“=”),理由为该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快.
③200℃时,测得E的容器容积为10L.该温度下,反应的平衡常数K=2500;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为0<x<58.
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景.T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,其它条件不变,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是B(填选项字母).
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g) C.加入催化剂 D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
已知:25℃时,几种酸的电离平衡常数如下表所示.
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
13. 如图表示某有机反应,该反应的类型是( )
如图表示某有机反应,该反应的类型是( )
 如图表示某有机反应,该反应的类型是( )
如图表示某有机反应,该反应的类型是( )| A. | 取代反应 | B. | 加成反应 | C. | 氧化反应 | D. | 聚合反应 |
7.下列物质属于电解质的是( )
| A. | 铁线 | B. | 蔗糖 | C. | 氯化钠 | D. | 盐酸 |
8.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,3.36L SO3含有的原子数目为0.6NA | |
| B. | 1 molNa2O2与足量的水反应,转移的电子数为2NA | |
| C. | 在常温常压下,13.8克NO2与足量水充分反应,剩余气体的分子数为0.1NA | |
| D. | 在1 L lmol•L-1的氨水中,含有的NH3与NH3•H2O分子的总数等于1 NA |
 根据如图的物理模型,回答问题:
根据如图的物理模型,回答问题: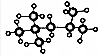 ,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;
,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3; .
.