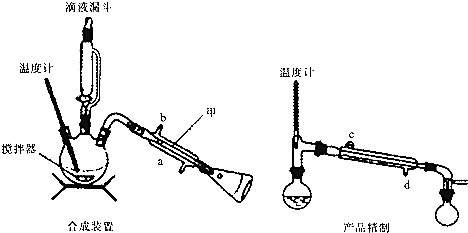
题目内容
14. 根据如图的物理模型,回答问题:
根据如图的物理模型,回答问题:(1)该模型是该物质的球棍模型(填“球棍”或“比例”).
(2)该物质的分子式为C9H11NO2.
(3)该物质含有的官能团有-COOH、-NH2,其对应名称为羧基、氨基.
分析 (1)球棍模型主要体现的是分子的空间结构和成键类型,比例模型主要体现的是组成该分子的原子间的大小关系;
(2)根据球棍模型中的成键特点和原子半径大小,可以判断大黑球为C、小黑球为H,条纹球为N,格子球为O,以此写出分子式;
(3)该有机物含有的官能团为-COOH和-NH2.
解答 解:(1)该模型中可以体现出成键类型和分子的空间结构,是该物质的球棍模型,故答案为:球棍;
(2)根据球棍模型中的成键特点和原子半径大小,可以判断大黑球为C、小黑球为H,条纹球为N,格子球为O,该有机物的分子式为C9H11NO2,故答案为:C9H11NO2;
(3)该有机物含有的官能团为-COOH和-NH2,对应的名称为羧基和氨基,故答案为:-COOH;-NH2;羧基;氨基.
点评 本题考查了球棍模型,注意根据球棍模型中的成键特点和原子半径大小判断原子种类,从而写出化学式和结构简式,题目难度中等,注意本题中的单键和双键等化学键都是以单键表示.

练习册系列答案
相关题目
4.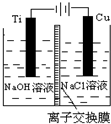 纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制阳极电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )
纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制阳极电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )
 纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制阳极电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )
纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制阳极电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )| A. | 钛(Ti)电极表面发生氧化反应 | |
| B. | 阳极附近溶液的pH逐渐减小 | |
| C. | 离子交换膜宜采用阴离子交换膜 | |
| D. | 阳极表面总反应式是:2Cu+2OH--2e-═Cu2O+H2O |
5.下列离子方程式中正确的是( )
| A. | 碳酸钙与盐酸混合:2H++CO32-═CO2↑+H2O | |
| B. | Al投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ | |
| C. | 亚硫酸钠溶液与稀硫酸混合:2H++SO32-═SO2↑+H2O | |
| D. | 二氧化锰与浓盐酸混合后加热:MnO2+4H++4Cl-═MnCl2+Cl2↑+2H2O |
2.瓦斯气中含有甲烷,它是煤矿安全生产的“大敌”,为防止瓦斯爆炸,需要不断地向坑道中鼓入空气以排除坑道内的瓦斯气.若将甲烷与空气混合于某容器中点燃,当爆炸最剧烈时,甲烷与空气的体积比为(同温、同压下)( )
| A. | 1:2 | B. | 2:5 | C. | 1:10 | D. | 1:8 |
19.今有原子序数依次培大的A.B、C、D、E、F六种元素.已知A、C、E三元素原子的最外层共有10个电子.且这三种元素的最高价氧化物对应的水化物之间,两两皆能反应且均能生成盐和水.D和F各有如下表的电子层结构.
按要求填空:
(1)各元素的元素符号分别为BMg,ES,FCl;
(2)试写出A、C最高价氧化物对应的水化物之间反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O
(3)D、E氢化物的稳定性:H2S>SiH4
(4)试写出A、B、E、F形成的简单离子半径由小到大的顺序:S2->Cl->Na+>Mg2+.
| 元素 | 最外层电子数 | 次外层电子数 |
| D | x | x+4 |
| F | x+3 | x+4 |
(1)各元素的元素符号分别为BMg,ES,FCl;
(2)试写出A、C最高价氧化物对应的水化物之间反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O
(3)D、E氢化物的稳定性:H2S>SiH4
(4)试写出A、B、E、F形成的简单离子半径由小到大的顺序:S2->Cl->Na+>Mg2+.
18.下列实验中制取气体的药品和装置图正确的是( )
| A. |  制NH3 | B. |  制Cl2 | C. |  制乙酸乙酯 | D. |  制Fe(OH)2 |
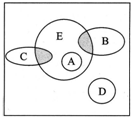 如图方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示4种基本反应类型.
如图方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示4种基本反应类型. ;
;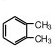 ;
;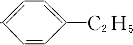 、
、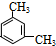 .
. 实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.