题目内容
9.下列过程中吸收热量的是( )| A. | 液氨气化 | B. | 酸城中和 | C. | 浓硫酸加水稀释 | D. | 镁条与盐酸反应 |
分析 A.气化是液态变为气态,吸收热量;
B.酸碱中和反应属于放热反应;
C.浓硫酸稀释过程中放出大量的热量;
D.活泼金属与酸的反应属于放热反应.
解答 解:A.液氨气化过程中液氨吸收能量变为氨气,故A正确;
B.酸碱中和反应属于放热反应,故B错误;
C.浓硫酸加水稀释过程中放出大量的热量,故C错误;
D.镁条与盐酸的反应属于放热反应,故D错误;
故选A.
点评 本题考查了物质变化过程中的能量变化,难度不大,重点掌握常见的放热反应和吸热反应类型.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列离子方程式中正确的是( )
| A. | 碳酸钙与盐酸混合:2H++CO32-═CO2↑+H2O | |
| B. | Al投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ | |
| C. | 亚硫酸钠溶液与稀硫酸混合:2H++SO32-═SO2↑+H2O | |
| D. | 二氧化锰与浓盐酸混合后加热:MnO2+4H++4Cl-═MnCl2+Cl2↑+2H2O |
14.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 能使甲基橙变红的溶液中:Na+、K+、SO${\;}_{4}^{2-}$、AlO${\;}_{2}^{-}$ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的澄清溶液中:Cu2+、Mg2+、SO42-、NO${\;}_{3}^{-}$ | |
| C. | 0.1mol•L-1FeCl2溶液中:Al+、Ca2+、SCN-、ClO- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ |
18.下列实验中制取气体的药品和装置图正确的是( )
| A. |  制NH3 | B. |  制Cl2 | C. |  制乙酸乙酯 | D. |  制Fe(OH)2 |
19.下列实验装置(部分固定装置略去)和有关叙述正确的是( )
| A. |  可以进行酸碱中和滴定实验 | |
| B. |  可以进行中和热的测定实验 | |
| C. |  可验证温度对化学平衡的影响 | |
| D. |  比较Cu2+、Fe3+对H2O2分解速率的影响 |
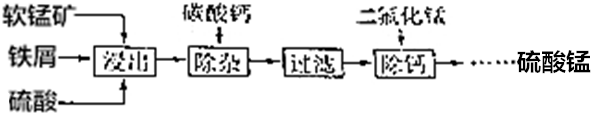
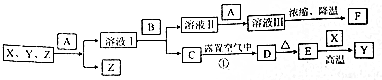
 ;
;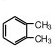 ;
;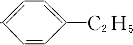 、
、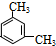 .
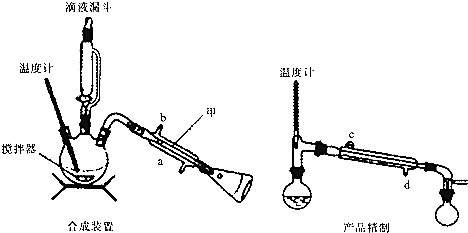
. 实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.