题目内容
8.设NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 标准状况下,3.36L SO3含有的原子数目为0.6NA | |
| B. | 1 molNa2O2与足量的水反应,转移的电子数为2NA | |
| C. | 在常温常压下,13.8克NO2与足量水充分反应,剩余气体的分子数为0.1NA | |
| D. | 在1 L lmol•L-1的氨水中,含有的NH3与NH3•H2O分子的总数等于1 NA |
分析 A.标准状况下,三氧化硫不是气体;
B.过氧化钠中氧元素的化合价为-1价,1mol Na2O2与水完全反应生成0.5mol氧气,转移了1mol电子;
C.3mol二氧化氮与水反应生成1molNO;
D.一水合氨是弱电解质,在溶液中能部分电离.
解答 解:A.标准状况下,三氧化硫不是气体,无法计算物质的量,故A错误;
B.1mol Na2O2与水完全反应生成0.5mol氧气,转移了1mol电子,转移电子数为 NA,故B错误;
C.3mol二氧化氮与水反应生成1molNO,13.8克NO2的物质的量为0.3mol,与足量水充分反应,剩余气体的分子数为0.1NA,故C正确;
D.一水合氨是弱电解质,在溶液中能部分电离,故溶液中的一水合氨分子的个数小于NA个,故D错误.
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
18.下列实验中制取气体的药品和装置图正确的是( )
| A. |  制NH3 | B. |  制Cl2 | C. |  制乙酸乙酯 | D. |  制Fe(OH)2 |
19.下列实验装置(部分固定装置略去)和有关叙述正确的是( )
| A. | 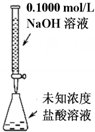 可以进行酸碱中和滴定实验 | |
| B. | 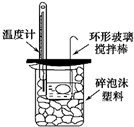 可以进行中和热的测定实验 | |
| C. | 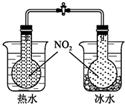 可验证温度对化学平衡的影响 | |
| D. | 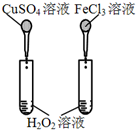 比较Cu2+、Fe3+对H2O2分解速率的影响 |
16.下列实验现象与氧化还原反应有关的是( )
| A. | 氧化铝可以与氢氧化钠溶液反应 | |
| B. | 向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成 | |
| C. | 氯气通入石蕊中先变红后褪色 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
3.在某无色透明溶液中,能共存的离子组是( )
| A. | Na+、SO42-、Cu2+、Cl- | B. | Fe2+、NO3-、Na+、Al3+ | ||
| C. | Mg2+、H+、Cl-、NO3- | D. | Ag+、K+、NO3-、Cl- |
13.Rm-有n个电子,它的质量数为A,则原子核内的中子数为( )
| A. | A+n+m | B. | A+n-m | C. | A-n+m | D. | A-n-m |
20.SF6分子结构中只存在S-F键,是优良的绝缘气体,制备原理如下:S(s)+3F2(g)→SF6(g)△H=?;已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F-F、S-F键需吸收的能量分别为160kJ、330kJ.则△H的值为(单位:kJ?mol-1)( )
| A. | 1780 | B. | 1220 | C. | -1220 | D. | -1780 |
17.下列说法正确的是( )
| A. | 分子式C7H16的烃,分子中有4个甲基的同分异构体有4种(不考虑立体异构) | |
| B. | 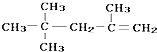 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| C. | 化合物 是苯的同系物 是苯的同系物 | |
| D. | 苯和溴水在三溴化铁做催化剂的条件下发生取代反应 |
18.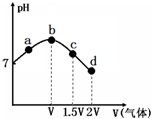 常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )
常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )
 常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )
常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )| A. | 由a点到b点的过程中,溶液中$\frac{{c(N{H_3}•{H_2}O)}}{c(NH_4^+)}$增大 | |
| B. | 由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性 | |
| C. | c点所示溶液中,c(NH4+)>c(CO32-)>c(OH-)>c(H+) | |
| D. | d点所示溶液中,c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) |