题目内容
13. 如图表示某有机反应,该反应的类型是( )
如图表示某有机反应,该反应的类型是( )| A. | 取代反应 | B. | 加成反应 | C. | 氧化反应 | D. | 聚合反应 |
分析 由图示可知,有机物含有碳碳双键,为乙烯,反应之后形成C-C键,应为加成反应,以此解答.
解答 解:由图知,第一种分子中的不饱和键断裂,为乙烯分子,反应中断键原子与另一种分子断裂产生的原子相结合,生成新的化合物的反应,属于加成反应.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意加成反应的判断,难度不大,理解相关的定义是解题的关键.

练习册系列答案
相关题目
8.下列化合物中,不能由化合反应直接制得的是( )
| A. | FeCl3 | B. | FeCl2 | C. | FeS | D. | Al(OH)3 |
18.下列实验中制取气体的药品和装置图正确的是( )
| A. |  制NH3 | B. |  制Cl2 | C. |  制乙酸乙酯 | D. |  制Fe(OH)2 |
5.下表为元素周期表前四周期的一部分,其中的编号代表对应的元素.
(1)表中元素⑩的价层电子排布图为 ;
;
(2)由元素⑩⑤⑦组成一种原子个数比为1:5:5的配位化合物,该物质常温下呈液态,熔点为20.5℃,沸点为103℃,易溶于非极性溶剂.据此可判断:该化合物的晶体中存在的作用力有BDF;
A.离子键 B.极性键 C.非极性键 D.范德华力 E.氢键 F.配位键
(3)元素⑤⑥⑦⑧的第一电离能由大到小的顺序是(用元素符号表示)F>N>O>C,元素①分别与⑤⑥⑦形成最简单的常见化合物分子甲、乙和丙.下列有关叙述不正确的有CD;
A.甲、乙和丙分子的空间构型分别为正四面体型、三角锥形、V型
B.甲、乙和丙分子中,中心原子的杂化类型均为sp3
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(4)元素①④⑦能形成原子个数比为3:1:3的一元含氧酸,该酸能溶于水且能促进水的电离,此过程生成的离子中④原子满足最外层8电子的稳定结构,请写出该酸溶于水时的电离方程式H3BO3+H2O?[B(OH)4]-+H+;
(5)②、③均是金属元素,可分别与⑦形成同种类型的晶体Ⅰ和晶体Ⅱ,二者熔点如表所示.试指出后者熔点比前者高出许多的原因:BeO、Li2O均形成离子晶体,Be2+离子所带电荷比Li+离子的高,且半径比Li+离子的小,故BeO的晶格能比Li2O的晶格能大;
(6)元素⑤可形成多种单质,其中石墨是良好的电极材料.石墨嵌入化合物有许多独特的性质,某钾(•)的石墨嵌入化合物层状结构如图所示,该层化合物的化学式为KC12.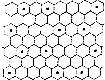
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||
| ⑨ | ⑩ |
 ;
;(2)由元素⑩⑤⑦组成一种原子个数比为1:5:5的配位化合物,该物质常温下呈液态,熔点为20.5℃,沸点为103℃,易溶于非极性溶剂.据此可判断:该化合物的晶体中存在的作用力有BDF;
A.离子键 B.极性键 C.非极性键 D.范德华力 E.氢键 F.配位键
(3)元素⑤⑥⑦⑧的第一电离能由大到小的顺序是(用元素符号表示)F>N>O>C,元素①分别与⑤⑥⑦形成最简单的常见化合物分子甲、乙和丙.下列有关叙述不正确的有CD;
A.甲、乙和丙分子的空间构型分别为正四面体型、三角锥形、V型
B.甲、乙和丙分子中,中心原子的杂化类型均为sp3
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(4)元素①④⑦能形成原子个数比为3:1:3的一元含氧酸,该酸能溶于水且能促进水的电离,此过程生成的离子中④原子满足最外层8电子的稳定结构,请写出该酸溶于水时的电离方程式H3BO3+H2O?[B(OH)4]-+H+;
(5)②、③均是金属元素,可分别与⑦形成同种类型的晶体Ⅰ和晶体Ⅱ,二者熔点如表所示.试指出后者熔点比前者高出许多的原因:BeO、Li2O均形成离子晶体,Be2+离子所带电荷比Li+离子的高,且半径比Li+离子的小,故BeO的晶格能比Li2O的晶格能大;
| 晶体Ⅰ | 晶体Ⅱ | |
| 熔点/K | 1840 | 2803 |

3.在某无色透明溶液中,能共存的离子组是( )
| A. | Na+、SO42-、Cu2+、Cl- | B. | Fe2+、NO3-、Na+、Al3+ | ||
| C. | Mg2+、H+、Cl-、NO3- | D. | Ag+、K+、NO3-、Cl- |
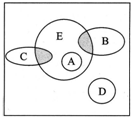 如图方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示4种基本反应类型.
如图方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示4种基本反应类型.
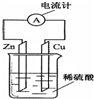 如图是铜锌原电池的装置示意图.回答下列问题:
如图是铜锌原电池的装置示意图.回答下列问题: