题目内容
7.1mol乙烯与Cl2完全加成,其产物再与Cl2彻底取代,两个过程中共用Cl2( )| A. | 2mol | B. | 4mol | C. | 5mol | D. | 6mol |
分析 乙烯和氯气发生加成反应生成二氯乙烷,1mol双键加成需要1mol的氯气;有机物中的氢原子被氯原子取代时,取代的氢原子的物质的量与氯气的物质的量相等,所以最多消耗的氯气为这两部分之和.
解答 解:解:CH2=CH2+Cl2→CH2ClCH2Cl,所以1mol乙烯与氯气发生加成反应需要氯气1mol;
CH2ClCH2Cl+4Cl2$\stackrel{光照}{→}$CCl3CCl3+4HCl,所以1molCH2ClCH2Cl与氯气发生取代反应,最多需要4mol氯气,这两部分之和为1mol+4mol=5mol.
故选C.
点评 本题考查了取代反应和加成反应,为高频考点,侧重于学生的分析能力和计算能力的考查,明确加成反应和取代反应中各反应物之间物质的量的关系是解本题的关键,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
18.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 | |
| D. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16族 |
15.标准状况下,将NO2、NO、O2 混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器中HNO3溶液的物质的量的浓度(mol/L)用M表示范围是( )
| A. | $\frac{1}{28}$<M<$\frac{1}{22.4}$ | B. | $\frac{1}{39.2}$<M<$\frac{1}{22.4}$ | C. | $\frac{1}{39.2}$<M<$\frac{1}{28}$ | D. | 0<M<$\frac{1}{22.4}$ |
12.某元素一种同位素的原子的质子数为m,中子数为n,则下列说法正确的是( )
| A. | 这种元素的原子量为m | |
| B. | 不能由此确定该元素的相对原子质量 | |
| C. | (m+n)可写在该元素符号的左上角 | |
| D. | 核内中子的总质量小于质子的总质量 |
19.下列各表述与示意图一致的是( )
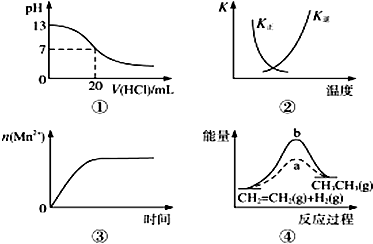

| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的p随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
16.现有核电荷数小于20的元素A,其电离能数据如下:(I1表示失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:×102 kJ•mol-1)
(1)外层电子离核越远,能量越高,电离能越小(填“大”或“小”);阳离子电荷数越高,失去电子时,电离能越大(填“大”或“小”).
(2)上述11个电子分属3个电子层.
(3)失去了11个电子后,该元素还有1个电子.
(4)该元素最高价氧化物对应水化物的化学式是Mg(OH)2.
| 序号 | I1 | I2 | I3 | I4 | I5 | I6 |
| 电力能 | 7.644 | 15.03 | 80.12 | 109.3 | 141.2 | 186.5 |
| 序号 | I7 | I8 | I9 | I10 | I11 | … |
| 电力能 | 224.9 | 266.0 | 327.9 | 367.4 | 1761 | … |
(2)上述11个电子分属3个电子层.
(3)失去了11个电子后,该元素还有1个电子.
(4)该元素最高价氧化物对应水化物的化学式是Mg(OH)2.
 .
.