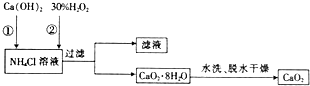
题目内容
19.按要求填空:(l)0.4mol氨气和0.2mol硫化氢的质量之比为1:1,所含分子数之比为2:1.
(2)现有NH3、H2S、HCl三种气体,它们分别都含有1mol氢原子,则三种气体的物质的量之比为2:3:6.
(3)以下物质:①碳酸钾 ②空气 ③二氧化碳 ④铜 ⑤食盐 ⑥氢氧化钠 ⑦硫酸铜溶液 ⑧酒精 ⑨蔗糖(Cl2H22O11).其中属于电解质的是①⑤⑥ (填序号).
分析 (l)根据m=nM判断二者质量之比,根据N=nNA计算所含分子数之比;
(2)根据各分子中含有H原子数目计算各物质的物质的量,据此解答;
(3)电解质:在水溶液中或熔融状态下能够导电的化合物;单质和混合物不是电解质.
解答 解:(1)0.4mol氨气和0.2mol硫化氢的质量之比为0.4mol×17g/mol:0.2mol×34g/mol=1:1,N=nNA,所含分子数之比为0.4mol:0.2mol=2:1,
故答案为:1:1; 2:1;
(2)NH3、H2S、HCl三种物质,分别都含有1mol氢原子,
则n(NH3)=$\frac{1}{3}$mol、n(H2S)=$\frac{1mol}{2}$=0.5mol、n(HCl)=1mol,
故n(NH3):n(H2S):n(HCl)=$\frac{1}{3}$mol:0.5mol:1mol=2:3:6,
故答案为:2:3:6;
(3)①碳酸钾在水溶液中或熔融状态下能够导电,是电解质;
②空气属于混合物,不属于电解质;
③二氧化碳在水溶液里,生成碳酸,碳酸能电离出自由移动的氢离子和碳酸根离子导致导电,不是二氧化碳自身电离,所以二氧化碳是非电解质,不属于电解质;
④电解质,必须是指化合物,铜为金属单质,不属于电解质;
⑤在水溶液里或在熔融状态下,能电离出自由移动的钠离子和氯离子导致导电,所以NaCl是电解质;
⑥NaOH在水溶液里或在熔融状态下,能电离出自由移动的钠离子和氢氧根离子导致导电,所以NaOH是电解质;
⑦硫酸铜溶液 为混合物,不属于电解质;
⑧酒精⑨蔗糖(Cl2H22O11). 在水中存在分子,没有自由移动的离子,故不能导电,是非电解质,不属于电解质;
故答案为:①⑤⑥.
点评 本题考查物质的量的相关计算、电解质的判别,题目难度不大,注意分子的组成,注意对公式的理解、概念的辨析与灵活运用.

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
已知:在一定条件下可发生反应:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0
I.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择a(填序号字母),原因是因反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
a.520~530K B.1350~1360K
II.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |

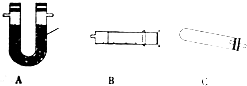
A中是HCl的发生装置,你认为应选择下列哪套装置?d(填装置的序号字母),装置D中碱石灰的作用为吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解;

(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为分馏(填操作名称),下列不是该操作所需的仪器是bd(填装置序号字母);
a.冷凝管 b. 圆底烧瓶 c. 蒸馏烧瓶 d. 分液漏斗 e.温度计 f.接受器
(3)用SiHCl3与H2反应制备纯硅的装置如下:

①按图示组装好仪器后,下列实验步骤的正确顺序为dbacef(填步骤的序号字母),
A.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
B.向装置中添加药品;
C.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
D.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为丙、丁(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是无尾气处理装置.
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(1)放出的能量相同 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
| A. | KClO3在反应中被还原 | |
| B. | 被还原与被氧化的氧元素的质量比为1:5 | |
| C. | H204在反应中既没被氧化也没被还原 | |
| D. | 生成1mol Cl2时有2mol电子转移 |
| A. | pH小于7的雨水被称为酸雨 | |
| B. | 推广使用燃煤脱硫技术,主要是为了防治SO2污染 | |
| C. | 为防止富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 明矾溶于水可产生具有吸附性的胶体粒子,常用于饮用水的杀菌消毒 |
 25℃时取浓度均为0.1000mol•L-1的CH3COOH(aq)和氨水各20mL,分别用0.1000mol•L-1NaOH(aq)、0.1000mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时取浓度均为0.1000mol•L-1的CH3COOH(aq)和氨水各20mL,分别用0.1000mol•L-1NaOH(aq)、0.1000mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到10.00mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅱ:滴加溶液到10.00mL时:c(CH3COO-)-c(CH3COOH)=2[c(OH-)-c(H+)] | |
| C. | 曲线Ⅱ:滴加溶液在10.00mL~20.00mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅰ:滴加溶液到20.00mL时,c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| A. | C2H4、C3H8 | B. | C2H6、C3H8 | C. | CH4、H2 | D. | C2H2、C3H6 |
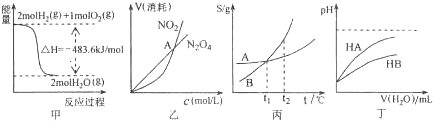
| A. | 甲图表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-1 | |
| B. | 乙图表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙图表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数仍为A%=B% | |
| D. | 丁图表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |