题目内容
7.已知 5KC1+KC103+3H2S04=3K3SO4+3Cl2+3H20,下列说法不正确的是( )| A. | KClO3在反应中被还原 | |
| B. | 被还原与被氧化的氧元素的质量比为1:5 | |
| C. | H204在反应中既没被氧化也没被还原 | |
| D. | 生成1mol Cl2时有2mol电子转移 |
分析 在反应5KC1+KC103+3H2S04=3K3SO4+3Cl2+3H20中,氯化钾中的氯由-1价变成0价,失电子发生氧化反应,而KC103中的氯由+5价变成0价,得电子发生还原反应,由此分析解答.
解答 解:A、KC103中的氯由+5价变成0价,得电子是氧化剂,发生还原反应,KClO3在反应中被还原,故A正确;
B、氯化钾中的氯由-1价变成0价,失电子发生氧化反应被氧化,而KC103中的氯由+5价变成0价,得电子发生还原反应,被还原,所以被还原与被氧化的氧元素的质量比为1:5,故B正确;
C、硫酸分子中各元素化合价未变,所以反应中既没被氧化也没被还原,故C正确;
D、生成3mol Cl2时有5mol电子转移,所以生成1mol Cl2时有$\frac{5}{3}$mol电子转移,故D错误;
故选D.
点评 本题考查氧化还原反应,侧重于学生的分析能力和基本概念的理解和运用的考查,注意从元素化合价的角度认识相关概念及相关物质的性质的判断,难度不大.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
17.常温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合. 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?a=7时,HA是强酸;a>7时,HA是弱酸.
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系C. A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+):
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-3-10-11mol•L-1.
(5)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B═H++HB-HB-?H++B2-
回答下列问题:
在 0.1mol•L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
| 实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
| 编号 | 浓度/(mol•L-1) | 浓度/(mol•L-1) | 液的 pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=11 |
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系C. A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+):
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-3-10-11mol•L-1.
(5)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B═H++HB-HB-?H++B2-
回答下列问题:
在 0.1mol•L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
18.饱和氯水久置后,溶液中的各种粒子:①Cl2②ClO-③Cl-④HClO ⑤H+减小的是( )
| A. | ①②④ | B. | ①②③ | C. | ①④ | D. | ②④ |
15.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含者丰富的化学原理,下列成语中涉及氧化还
原反应的是( )
原反应的是( )
| A. | 铁杵成针 | B. | 抱薪救火 | C. | 闭门造车 | D. | 刻舟求剑 |
17.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液中:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的FeCl3溶液中:K+NH4+、I-、SCN- | |
| D. | 0.1 mol•L-1的盐酸中:Fe2+、Na+、Br-、NO3- |
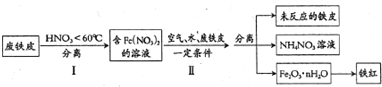
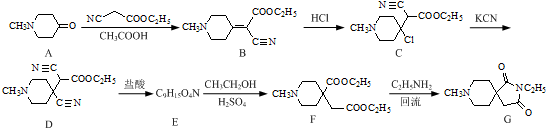
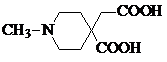 .
.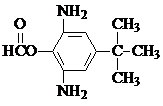 或
或 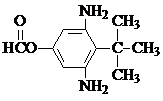 .
.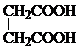 和CH3CH2Cl为原料制备
和CH3CH2Cl为原料制备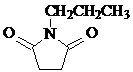 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: