题目内容
9.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,在350℃时会迅速分解生成CaO和O2,杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面,其工业生产流程如下: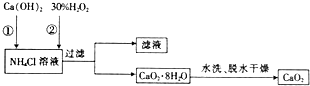
(1)步骤②制取CaO2•8H2O的反应不属于(填“属于”或“不属于”)氧化还原反应.
(2)该流程中可循环使用的物质是NH4Cl.
(3)检验CaO2•8H2O是否洗净的方法是取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净.
(4)在CaO2•8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是抑制CaO2分解和防止过氧化钙和二氧化碳反应.
(5)实验室用如图所示装置测定产品中CaO2的含量(加热、夹持、连接管等仪器省略).
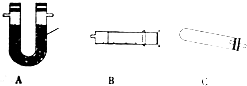
①装置连接的顺序为CAB(填字母);A中药品为碱石灰.
②写出实验开始前检验装置的气密性的方法:微热装置C针管活塞外移,冷却后恢复到原来的位置,表明装置气密性完好.
③若所取产品的质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为$\frac{9V}{1400}$×100%(用含m、V的代数式表示)
分析 (1)第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵,反应前后元素化合价变化分析判断是否为氧化还原反应;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵;
(3)实验室用硝酸酸化的硝酸银溶液检验是否含氯离子检验是否洗涤干净;
(4)CaO2能和水反应,氧气能抑制CaO2分解;
(5)①利用这种C加热固体超氧化钙生成过氧化钙和氧气,通过这种A吸收水蒸气,通过这种B测定生成氧气的体积;
②组装好装置,利用装置内压强改变,注射器中活塞移动来判断装置气密性;
③根据过氧化钙和氧气之间的关系式计算.
解答 解:(1)第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵,反应方程式为CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl,反应过程中无元素化合价的变化,不属于氧化还原反应,
故答案为:不属于;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵,所以可以循环使用的物质是NH4Cl,
故答案为:NH4Cl;
(3)实验室用硝酸酸化的硝酸银溶液检验,如果沉淀没有洗涤干净,向洗涤液中加入硝酸酸化的硝酸银溶液应该有白色沉淀,其检验方法是:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净,
故答案为:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净;
(4)CaO2能和水、二氧化碳反应,与水生成氢氧化钙和氧气,与二氧化碳反应生成碳酸钙和氧气,CaO2在350℃迅速分解生成CaO和O2,所以通入氧气能抑制超氧化钙分解;
故答案为:防止过氧化钙和二氧化碳反应;
(5)①利用这种C加热固体超氧化钙生成过氧化钙和氧气,通过这种A吸收水蒸气,通过这种B测定生成氧气的体积,装置连接的顺序为CAB,装置A中是固体干燥剂可以用碱石灰干燥氧气,
故答案为:CAB;碱石灰;
②组装好装置,微热装置C针管活塞外移,冷却后恢复到原来的位置,表明装置气密性完好,
故答案为:微热装置C针管活塞外移,冷却后恢复到原来的位置,表明装置气密性完好;
③设超氧化钙质量为x,
2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑
144g 22.4L
x 10-3VL
144g:22.4L=x:10-3VL
x=$\frac{144g×1{0}^{-3}VL}{22.4L/mol}$=$\frac{144V}{22400}$g=$\frac{9V}{1400}$,
其质量分数=$\frac{\frac{9V}{1400}g}{mg}$×100%=$\frac{9V}{1400}$×100%,
故答案为:$\frac{9V}{1400}$×100%.
点评 本题考查制备实验方案评价,为高频考点,侧重考查离子检验、实验基本操作、物质含量测定等知识点,明确实验原理及物质性质是解本题关键,难点是题给信息的挖掘和运用,题目难度中等.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | 未加NaOH溶液时:c(H+)>c(Cl-)=c(CH3COOH) | |
| B. | 加入l0mLNaOH溶液时:c(CH3COO-)+c(OH-)=c(H+) | |
| C. | 加入20mLNaOH溶液时:c(Na+)=c(CH3COOH)+c(CH3COO一) | |
| D. | 加入20mLNaOH溶液时,酸碱恰好中和:c(OH-)=c(H+) |
| A. | 0.1 mol•L-1的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液中:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的FeCl3溶液中:K+NH4+、I-、SCN- | |
| D. | 0.1 mol•L-1的盐酸中:Fe2+、Na+、Br-、NO3- |
 如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )
如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )| A. | 试剂1可以是铁也可以是铜 | |
| B. | 试剂2可以是盐酸也可以是硫酸 | |
| C. | 气体C为Cl2,不能用H2O2替换 | |
| D. | 步骤①②③中发生的反应均为氧化还原反应 |
| A. | 液氨、液氯、干冰、碘化银均为化合物 | |
| B. | 明矾、小苏打、醋酸、次氯酸均为电解质 | |
| C. | 碘酒、牛奶、豆浆、漂白粉均为胶体 | |
| D. | Na2O2、Na2CO3、Na2SiO3、KNO3均为盐 |
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | NaHCO3比Na2CO3稳定 | |
| C. | 澄清的石灰水能与Na2CO3反应,不与NaHCO3反应 | |
| D. | 等物质的量的Na2CO3和NaHCO3与等浓度足量的盐酸反应,消耗盐酸体积之比为2:1 |
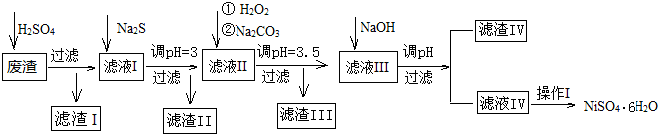
部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
| pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
(2)加Na2S同时调溶液的pH为3,目的是除去铜、锌等杂质,则往滤液Ⅱ中加入H2O2的反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作Ⅰ包括以下过程:冷却、结晶、过滤、洗涤、干燥.该洗涤过程不能用水洗涤,应该用酒精洗涤,目的是既能洗涤沉淀表面残余的溶液又有利晶体的干燥并减少NiSO4﹒6H2O晶体的损失.干燥有低温干燥和高温干燥,能否用高温干燥否,理由是温度过高会使NiSO4﹒6H2O晶体失去部分或全部结晶水.
(4)滤液Ⅲ中加入NaOH溶液的目的是调节溶液的pH为8以除去Al3+以及少量的Mg2+,若向含有Mg2+、Al3+的溶液中滴加NaOH溶液,常温下当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Al3+)=2.5×1013.{已知:25℃时,KSP[Mg(OH)2]=5.0×10-14;KSP[Al(OH)3]=2.0×10-33}.
| A. | 简单氢化物的热稳定性:Z>W | B. | 最高价氧化物的水化物的酸性:X<Z | ||
| C. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | D. | 沸点:XW2>Y2W |