题目内容
9.晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等,.以下是工业上制取纯硅的一种方法.
已知:在一定条件下可发生反应:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0
I.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择a(填序号字母),原因是因反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
a.520~530K B.1350~1360K
II.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
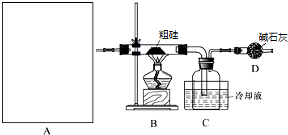
A中是HCl的发生装置,你认为应选择下列哪套装置?d(填装置的序号字母),装置D中碱石灰的作用为吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为分馏(填操作名称),下列不是该操作所需的仪器是bd(填装置序号字母);
a.冷凝管 b. 圆底烧瓶 c. 蒸馏烧瓶 d. 分液漏斗 e.温度计 f.接受器
(3)用SiHCl3与H2反应制备纯硅的装置如下:
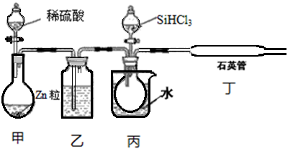
①按图示组装好仪器后,下列实验步骤的正确顺序为dbacef(填步骤的序号字母),
A.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
B.向装置中添加药品;
C.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
D.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为丙、丁(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是无尾气处理装置.
分析 Ⅰ.根据反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0可知,该反应为放热反应,根据温度对平衡移动的影响答题;
II.(1)根据题中制HCl的实验原理,为固体和液体加热,据此选择装置,反应中有剩余的氯化氢气体未反应,要吸收,同时SiHCl3易水解,要防止空气中的水分进入装置;
(2)液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,根据这些物质的沸点不同,可选择分馏的方法进行除杂,根据分馏操作的装置可选择仪器;
(3)用SiHCl3与H2反应制备纯硅,组装好仪器后,要先进行气密性检验,再在装置中通氢气,排尽空气后再进行SiHCl3与H2的反应,实验结束时还要继续通氢气,直到装置冷却,防止空气中的成分对反应干扰,根据装置可知,丙处是水浴,丁处进行SiHCl3与H2的反应,都要进行加热,实验尾气中有氯化氢等气体不能直接排到空气中,据此答题.
解答 解:Ⅰ.根据反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0可知,该反应为放热反应,升高温度,平衡移动会逆向移动,不利于SiHCl3的生成,所以选择温度较低的条件,即选a,
故答案为:a;因反应 Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
II.(1)根据题中制HCl的实验原理,为固体和液体加热,所以选择d装置,反应中有剩余的氯化氢气体未反应,要吸收,同时SiHCl3易水解,要防止空气中的水分进入装置,所以D中装碱石灰用来吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解,
故答案为:d;吸收剩余HCl;防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,根据这些物质的沸点不同,可选择分馏的方法进行除杂,所以流程中操作①为分馏,根据分馏操作的装置可知,不是分馏操作所需的仪器是b d,
故答案为:分馏;b d;
(3)①用SiHCl3与H2反应制备纯硅,组装好仪器后,要先进行气密性检验,再在装置中通氢气,排尽空气后再进行SiHCl3与H2的反应,实验结束时还要继续通氢气,直到装置冷却,防止空气中的成分对反应干扰,所以实验步骤的顺序为dbacef,根据装置可知,丙处是水浴,丁处进行SiHCl3与H2的反应,都要进行加热,所以步骤c中需要加热的装置为丙、丁,
故答案为:dbacef;丙、丁;
②实验尾气中有氯化氢等气体不能直接排到空气中,而根据装置可知,装置中无尾气处理装置,
故答案为:无尾气处理装置.
点评 本题考查制备实验方案的设计,题目难度中等,综合了氯气的制法、硅的提纯、物质的分离提纯、对装置与操作的分析评价等实验知识,结合物质的性质明确原理为解答的关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.

| 序号 | 各种化学变化 | 制备新物质或能量转化(主要) |
| 示例 | 实验室点燃酒精灯 | 化学能转变为热能 |
| 示例 | 利用氢气和氯气合成盐酸 | 制备新物质 |
| (1) | 从铜矿中提炼铜 | |
| (2) | 冬天,居民烧木炭取暖 | |
| (3) | 镁燃烧制照明弹 | |
| (4) | Pb+PbO2+2H2SO4$\frac{\underline{\;放电\;}}{\;}$2PbSO4+2H2O | |
| (5) | 6nH2O+6nCO2 $→_{叶绿素}^{光}$(C6H12O6)n+6nO2 |
| 实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
| 编号 | 浓度/(mol•L-1) | 浓度/(mol•L-1) | 液的 pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=11 |
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系C. A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+):
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-3-10-11mol•L-1.
(5)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B═H++HB-HB-?H++B2-
回答下列问题:
在 0.1mol•L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
回答下列问题:
①若将PH=3的HA溶液和PH=11的NaOH溶液等体积混合后,溶液的PH值<7(填>、<、=)
②若混合后溶液PH值等于7,则混合后溶液中各离子浓度大小次序为c(A-)=c(Na+)>c(OH-)=c(H+).
(2)已知常温下Ksp[Al(OH)3]=3×10-34;Ksp[Fe(OH)3]=4×10-38在25℃向浓度均为0.1mol/L的AlCl3和FeCl3混合溶液中逐滴加入氨水,
?请写出最先生成沉淀的离子方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.?当溶液PH=10时,C(Al3+)=3×10-22mol/L
(3)1909年化学家哈伯在实验室首次合成了氨.氨的应用较多,据此回答下列问题:合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g);
①写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$.
?②在一定条件下的2L密闭容器中进行实验,并测得下列数据
| 物质 | N2 | H2 | NH3 |
| 起始(mol) | 2 | 7 | 0 |
| 10s(mol) | 1.6 | ||
| 平衡(mol) | 2 |
?③在一定温度,一定体积的密闭容器中进行合成氨的实验,下列不可以判断反应达到平衡状态的为AD.
A、密度保持不变
B、平均分子量保持不变
C、气体的总物质的量保持不变
D、单位时间内每消耗1molN2的同时生成2mol氨气
④汽车尾气中含有较多的NO2和NO若任意排放可形成光化学烟雾,利用NH3可将其除去,同时得到不会污染空气的物质,试写出NH3与NO2反应的化学化学方程式8NH3+6NO2=7N2+12H2O.
| A. | 0.5mol/L KCl溶液 | B. | 自来水 | ||
| C. | 0.5mol/L盐酸 | D. | 0.5mol/L醋酸溶液 |
| A. | ①②④ | B. | ①②③ | C. | ①④ | D. | ②④ |