题目内容
8.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质);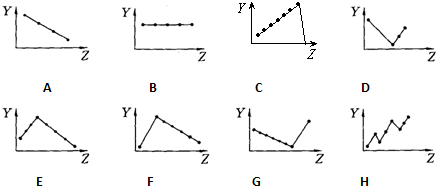
请把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅦA族元素氢化物的沸点D
(2)IA族元素单质熔点F
(3)第三周期元素的最高正化合价C
(4)第三周期元素基态原子的第一电离能H
(5)F-、Na+、Mg2+、Al3+四种离子的离子半径A.
分析 (1)ⅦA族元素氢化物的沸点依次升高,但HF沸点反常,最高;
(2)IA族元素碱金属单质熔点随原子序数的增大而减小;
(3)第三周期元素的最高正化合价随原子序数增大而增大;
(4)第三周期元素基态原子的第一电离能随原子序数的增大而增大,但ⅡA族与ⅤA族元素的第一电离能比相邻元素都大;
(5)电子层结构相同的离子其离子半径随着原子序数增大而减小.
解答 解:(1)ⅦA族元素氢化物的相对分子质量增大,范德华力增强,沸点依次升高,但HF形成分子间氢键,沸点反常,最高,故选D;
(2)IA族元素氢气是非金属单质,其余都是金属晶体,氢气单质的熔点最低,金属晶体的熔点与其原子半径成反比,所以碱金属族单质的熔点随着原子序数增大而减小,故选F;
(3)第三周期元素的最高正化合价随原子序数增大而增大,故选C;
(4)第三周期元素基态原子的第一电离能随原子序数的增大而增大,但ⅡA族与ⅤA族元素的价电子排布式为3S2和3S23P3,分别为S轨道全充满P轨道拌充满,较稳定,所以第一电离能比相邻元素都大,故选H;
(5)电子层结构相同的离子其离子半径随着原子序数增大而减小,故选A.
点评 本题考查原子结构和元素性质,侧重考查元素周期律,熟练掌握同一周期、同一主族元素性质变化规律,并灵活运用这些规律解题,注意规律中的异常现象,注意(5)中第IA族元素要考虑H元素,为易错点.考点基础但较为零散,需要熟练掌握规律及特例.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.关注科学、技术、社会与环境(STSE)人人有责.下列与STSE相关的说法不正确的是 ( )
| A. | 煤的主要成分是焦炭和无机物杂质 | |
| B. | 用家用汽车代替公交车不能达到节能减排的目的 | |
| C. | 汽车尾气的大量排放不仅会造成酸雨还可能引起光化学烟雾 | |
| D. | 添加三聚氰胺能增加奶制品的N元素含量,但是对人体有害 |
13.硝基苯酚是合成医药、染料、感光材料的中间体;以苯酚为原料制备硝基苯酚的步骤如下:
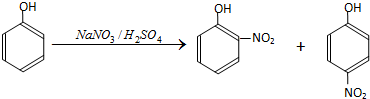
I.在常温下,向250mL三口烧瓶中加试剂(加入的试剂有:
A.50mL水;B.17.5gNaNO3;C.15mL浓硫酸
Ⅱ.称取4.7g苯酚,与1mL温水混合,并冷却至室温.
Ⅲ.在搅拌下,将苯酚水溶液自滴液漏斗滴入三口烧瓶中,将反应温度维持在20℃左右.
Ⅳ.加完苯酚后,继续搅拌1h,冷却至黑色油状物固化,倾出酸层.然后向油状物中加入20mL水并振摇,先倾出洗液,再用水洗三次,以除净残存的酸..
V.邻硝基苯酚的提纯.固化的黑色油状物主要成分是邻硝基苯酚和对硝基苯酚.
(1)步骤I中加入试剂的先后顺序为ACB(填序号)
(2)苯酚有腐蚀性,步骤Ⅱ中若不慎使苯酚触及皮肤,应立刻用酒精棉擦洗.苯酚中加少许水可降低熔点,使其中室温下即呈液态,这样操作的作用是便于滴加,同时也可以加快反应.
(3)步骤Ⅲ中,将反应温度维持在20℃左右的原因是当温度过高,一元硝基酚有可能发生进步硝化,当温度偏低,又将减缓反应速度.
(4)步骤Ⅳ中,若黑色油状物未固化,则可用分液漏斗(填实验仪器)将黑色油状物分出.
(5)根据题给信息,不使用温度计,设计步骤V得到纯净的邻硝基苯酚的实验方案;对油状混合物作水蒸气蒸馏,将馏出液冷却过滤,收集晶体,即得邻硝基苯酚产物.

I.在常温下,向250mL三口烧瓶中加试剂(加入的试剂有:
A.50mL水;B.17.5gNaNO3;C.15mL浓硫酸
Ⅱ.称取4.7g苯酚,与1mL温水混合,并冷却至室温.
Ⅲ.在搅拌下,将苯酚水溶液自滴液漏斗滴入三口烧瓶中,将反应温度维持在20℃左右.
Ⅳ.加完苯酚后,继续搅拌1h,冷却至黑色油状物固化,倾出酸层.然后向油状物中加入20mL水并振摇,先倾出洗液,再用水洗三次,以除净残存的酸..
V.邻硝基苯酚的提纯.固化的黑色油状物主要成分是邻硝基苯酚和对硝基苯酚.
| 密度 (g•mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 | 其他 | |
| 邻硝基苯酚 | 1.495 | 44.45 | 214 | 微溶于冷水,易溶于热水 | 能与水蒸气一同挥发 |
| 对硝基苯酚 | 11.481 | 113.4 | 279 | 稍溶于水 | 不与水蒸气一同挥发 |
(2)苯酚有腐蚀性,步骤Ⅱ中若不慎使苯酚触及皮肤,应立刻用酒精棉擦洗.苯酚中加少许水可降低熔点,使其中室温下即呈液态,这样操作的作用是便于滴加,同时也可以加快反应.
(3)步骤Ⅲ中,将反应温度维持在20℃左右的原因是当温度过高,一元硝基酚有可能发生进步硝化,当温度偏低,又将减缓反应速度.
(4)步骤Ⅳ中,若黑色油状物未固化,则可用分液漏斗(填实验仪器)将黑色油状物分出.
(5)根据题给信息,不使用温度计,设计步骤V得到纯净的邻硝基苯酚的实验方案;对油状混合物作水蒸气蒸馏,将馏出液冷却过滤,收集晶体,即得邻硝基苯酚产物.
20.测定结晶水合物中结晶水含量时,不需要的仪器是( )
| A. | 玻璃棒 | B. | 干燥器 | C. | 坩埚钳 | D. | 烧杯 |
17.下列事故处理不正确的是( )
| A. | 家用电器起火,常用液态CO2灭火,一般不用液态四氯化碳 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 | |
| D. | 实验后,剩余的药品不能随便丢弃(或浪费),应放回原瓶 |