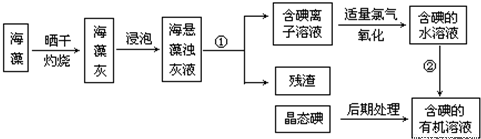
题目内容
6.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1mol甲基中含有的电子数为10NA | |
| B. | 22g CO2中含有共用电子对数4NA个 | |
| C. | 标准状况下22.4L氯仿(三氯甲烷)中共价键数目为4NA | |
| D. | 28g C2H4中含有2NA个碳原子 |
分析 A.甲基含有1个C、3个H,共有9个电子;
B.22g CO2为0.5mol,结构式为O=C=O,1个分子含有4个共用电子对;
C.氯仿在标况下为液体;
D.结合n=$\frac{m}{M}$计算物质的量,可确定碳原子数.
解答 解:A.甲基含有1个C、3个H,共有9个电子,1mol甲基中含有9mol电子,含有的电子数为9NA,故A错误;
B.22g CO2为0.5mol,结构式为O=C=O,1个分子含有4个共用电子对,则22g CO2中含有共用电子对数2NA个,故B错误;
C.氯仿在标况下为液体,无法确定物质的量,则不能计算共价键数目,故C错误;
D.28g C2H4的物质的量为1mol,含有2molC,数目为2NA个碳原子,故D正确.
故选D.
点评 本题综合考查阿伏伽德罗常数的分析应用,为高频考点,侧重于学生的分析能力和计算能力的考查,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列事故处理不正确的是( )
| A. | 家用电器起火,常用液态CO2灭火,一般不用液态四氯化碳 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 | |
| D. | 实验后,剩余的药品不能随便丢弃(或浪费),应放回原瓶 |
14. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的熵变△S<0 ( 填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
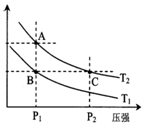
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
1.下列物质的保存方法正确的是( )
| A. | 少量白磷保存在冷水中 | B. | 氢氧化钠固体敞口放在空气中 | ||
| C. | 生石灰露置于空气中 | D. | 浓盐酸盛放在敞口玻璃瓶中 |
11.将NO2装入带有活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,改变某个条件,下列叙述正确的是( )
| A. | 升高温度,气体颜色加深,则此反应为吸热反应 | |
| B. | 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅 | |
| C. | 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 | |
| D. | 恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅 |
15.根据下列各题所给出的数据,得出的结论正确的是( )
| A. | 通入标准状况下HCl气体11.2L,可使1 L浓度为0.5mol/L的盐酸物质的量浓度增大到1mol/L | |
| B. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OH- | |
| C. | 将10g碳酸钙粉末加水配成100mL溶液,CaCO3物质的量浓度为1mol/L | |
| D. | 4g NaOH溶解在10mL水中,再稀释成1L,从中取1mL,这1mL溶液的物质的量浓度为0.1mol•L-1 |