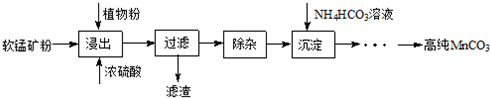
题目内容
18.X、Y、Z、W是原子序数依次增大的四种短周期元素.Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZZ,X和Z的原子最外层电子数之和等于W的原子最外层电子数,25℃时0.01mol/L X和W形成化合物的水溶液pH为2.下列说法正确的是( )| A. | Y元素含氧酸的酸性比W的弱 | |
| B. | Z和W在自然界均能以游离态存在 | |
| C. | YZ和YZ2均可以被NaOH溶液吸收 | |
| D. | X和Y能形成既含极性键又含非极性键的分子 |
分析 X、Y、Z、W是原子序数依次增大的四种短周期元素,25℃时0.01mol/L X和W形成化合物的水溶液pH为2,则二者形成的化合物是一元强酸,则X是H元素、W是Cl元素;
Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZ2,X和Z的原子最外层电子数之和等于W的原子最外层电子数,则Z最外层电子数是6,为O元素,Y为C元素,
A.Y是C、W是Cl元素,碳酸的酸性不一定比Cl元素含氧酸的酸性弱;
B.Z为O元素、W为Cl元素,Cl元素在自然界中以化合态存在;
C.CO和CO2为不成盐氧化物;
D.同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键.
解答 解:X、Y、Z、W是原子序数依次增大的四种短周期元素,25℃时0.01mol/L X和W形成化合物的水溶液pH为2,则二者形成的化合物是一元强酸,则X是H元素、W是Cl元素;
Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZ2,X和Z的原子最外层电子数之和等于W的原子最外层电子数,则Z最外层电子数是6,为O元素,Y为C元素,
A.Y是C、W是Cl元素,碳酸的酸性不一定比Cl元素含氧酸的酸性弱,如碳酸酸性大于次氯酸,故A错误;
B.Z为O元素、W为Cl元素,Cl元素性质较活泼,在自然界中以化合态存在,故B错误;
C.CO为不成盐氧化物,所以不能和NaOH溶液反应,故C错误;
D.同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,X和Y能形成既含极性键又含非极性键的分子,如含有多个碳原子的烃,故D正确;
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,涉及酸性强弱判断、化学键、元素化合物性质等知识点,侧重考查学生分析判断能力,易错选项是A,注意部分Cl元素的含氧酸酸性较弱,题目难度不大.

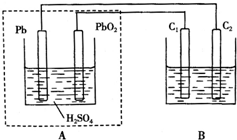 用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )
用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )| A. | 铅蓄电池工作一段时间后A溶液的pH变小 | |
| B. | 当B烧杯中I-的浓度降为0.05mol/L时,消耗A中的H2SO4的物质的量为0.025mol | |
| C. | 当C1、C2两极均产生气体时,应有至少3.6×1022个电子从电路中流过 | |
| D. | 铅蓄电池工作时负极电极反应式为:PbO2-2e-+H2SO4═PbSO4+2H2O+SO${\;}_{4}^{2-}$ |
| A. | 用氯化铁溶液腐蚀铜板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体, | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY强 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
| A. | A | B. | B | C. | C | D. | D |
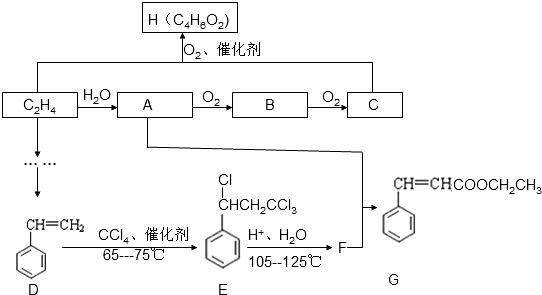
 是G的一种同分异构体
是G的一种同分异构体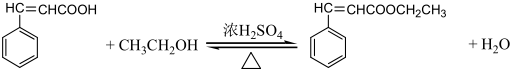 .
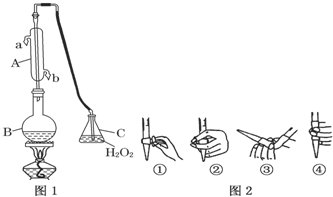
.
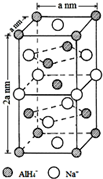 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. .
. (标明配位键).
(标明配位键).