题目内容
有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.A的原子半径在元素周期表中最小,B最外层电子数是次外层电子数的2倍,C是空气中含量最多的元素.D、F同主族,E、F同周期.D的同素异形体中有一种在大气层中起保护作用.E的离子半径是同周期简单离子中最小的.物质甲由D、E、F三种元素组成.
请回答:
(1)写出F的离子结构示意图 .
(2)C位于元素周期表第 期第 族,写出C的最简单氢化物发生催化氧化的化学方程式 .
(3)甲可用作浊水净化剂,其原理是 (用离子方程式表示);在消防工业中,与 (填名称)、发泡剂组成泡沫灭火剂.
(4)处理含BO、FO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质F和BO2.
已知:BO(g)+
O2(g)=BO2(g)△H=-283.0kJ?mol-1
F(s)+O2(g)=FO2(g)△H=-296.0kJ?mol-1
此反应的热化学方程式是 .
(5)往5.0mL 0.1mol?L-1甲溶液中加入20.0mL 0.1mol?L-1Ba(OH)2溶液,充分反应后溶液中离子浓度从大到小的顺序是 .
请回答:
(1)写出F的离子结构示意图
(2)C位于元素周期表第
(3)甲可用作浊水净化剂,其原理是
(4)处理含BO、FO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质F和BO2.
已知:BO(g)+
| 1 |
| 2 |
F(s)+O2(g)=FO2(g)△H=-296.0kJ?mol-1
此反应的热化学方程式是
(5)往5.0mL 0.1mol?L-1甲溶液中加入20.0mL 0.1mol?L-1Ba(OH)2溶液,充分反应后溶液中离子浓度从大到小的顺序是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,A的原子半径在元素周期表中最小,则A是H元素;
B最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,第一电子层为最外层时其电子数不超过2个,所以B是C元素;
C是空气中含量最多的元素,则C是N元素;
D的同素异形体中有一种在大气层中起保护作用,则D为O元素;
D、F同主族,且属于短周期元素,则F是S元素;
E、F同周期,E的离子半径是同周期简单离子中最小的,则E是Al元素,物质甲由D、E、F三种元素组成,甲可用作浊水净化剂,则甲是Al2(SO4)3,再结合题目分析解答.
B最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,第一电子层为最外层时其电子数不超过2个,所以B是C元素;
C是空气中含量最多的元素,则C是N元素;
D的同素异形体中有一种在大气层中起保护作用,则D为O元素;
D、F同主族,且属于短周期元素,则F是S元素;
E、F同周期,E的离子半径是同周期简单离子中最小的,则E是Al元素,物质甲由D、E、F三种元素组成,甲可用作浊水净化剂,则甲是Al2(SO4)3,再结合题目分析解答.
解答:
解:A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,A的原子半径在元素周期表中最小,则A是H元素;
B最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,第一电子层为最外层时其电子数不超过2个,所以B是C元素;
C是空气中含量最多的元素,则C是N元素;
D的同素异形体中有一种在大气层中起保护作用,则D为O元素;
D、F同主族,且属于短周期元素,则F是S元素;
E、F同周期,E的离子半径是同周期简单离子中最小的,则E是Al元素,物质甲由D、E、F三种元素组成,甲可用作浊水净化剂,则甲是Al2(SO4)3,
(1)F是S元素,S2-核外有3个电子层最外层有8个电子,则S2-的离子结构示意图 ,故答案为:
,故答案为: ;
;
(2)C是N元素,其原子核外有2个电子最外层电子数是5,则N元素位于元素周期表第二期第VA族,氨气在催化剂、加热条件下发生氧化还原反应生成NO和H2O,化学方程式为4NH3+5O2
4NO+6H2O,故答案为:二;VA;4NH3+5O2
4NO+6H2O;
(3)甲中含有Al3+,水解生成Al(OH)3胶体,胶体具有吸附性而净水,水解方程式为Al3++3H2O?Al(OH)3(胶体)+3H+;在消防工业中,与小苏打、发泡剂发生双水解反应生成二氧化碳,从而组成泡沫灭火剂,故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;小苏打;
(4)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S和CO2,
CO(g)+
O2(g)=CO2(g)△H=-283.0kJ?mol-1 ①
S(s)+O2(g)=SO2(g)△H=-296.0kJ?mol-1 ②
根据盖斯定律知,将方程式2①-②得2CO(g)+SO2(g)=S(s)+2CO2(g),△H=2(-283.0kJ?mol-1)-(-296.0kJ?mol-1)=-270.0kJ/mol,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g),△H=-270.0kJ/mol;
(5)n[Al2(SO4)3]=0.1mol/L×0.005L=0.0005mol,n[Ba(OH)2]=0.1mol/L×0.02L=0.002mol,
n(Al3+)=2n[Al2SO4)3]=0.001mol,
n(SO4 2- )=3n[Al2(SO3)3]=0.0015mol,
n(Ba2+)=n[Ba(OH)2]=0.002mol,
n(OH-)=2n[Ba(OH)2]=0.004mol,
根据Al3++4OH-=AlO2-+2H2O、Ba2++SO4 2-=BaSO4↓知,
Al3+完全被转化为AlO2-,n(SO4 2- )<n(Ba2+),所以溶液中有钡离子剩余,且剩余n(Ba2+)=0.002mol-0.0015mol=0.0005mol<n(AlO2-)=0.001mol,
偏铝酸根离子水解导致溶液呈碱性,但水解程度较小,所以溶液中离子浓度大小顺序是c(AlO2-)>c(Ba2+)>c(OH-)>c(H+),
故答案为:c(AlO2-)>c(Ba2+)>c(OH-)>c(H+).
B最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,第一电子层为最外层时其电子数不超过2个,所以B是C元素;
C是空气中含量最多的元素,则C是N元素;
D的同素异形体中有一种在大气层中起保护作用,则D为O元素;
D、F同主族,且属于短周期元素,则F是S元素;
E、F同周期,E的离子半径是同周期简单离子中最小的,则E是Al元素,物质甲由D、E、F三种元素组成,甲可用作浊水净化剂,则甲是Al2(SO4)3,
(1)F是S元素,S2-核外有3个电子层最外层有8个电子,则S2-的离子结构示意图
 ,故答案为:
,故答案为: ;
;(2)C是N元素,其原子核外有2个电子最外层电子数是5,则N元素位于元素周期表第二期第VA族,氨气在催化剂、加热条件下发生氧化还原反应生成NO和H2O,化学方程式为4NH3+5O2
| ||
| △ |
| ||
| △ |
(3)甲中含有Al3+,水解生成Al(OH)3胶体,胶体具有吸附性而净水,水解方程式为Al3++3H2O?Al(OH)3(胶体)+3H+;在消防工业中,与小苏打、发泡剂发生双水解反应生成二氧化碳,从而组成泡沫灭火剂,故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;小苏打;
(4)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S和CO2,
CO(g)+
| 1 |
| 2 |
S(s)+O2(g)=SO2(g)△H=-296.0kJ?mol-1 ②
根据盖斯定律知,将方程式2①-②得2CO(g)+SO2(g)=S(s)+2CO2(g),△H=2(-283.0kJ?mol-1)-(-296.0kJ?mol-1)=-270.0kJ/mol,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g),△H=-270.0kJ/mol;
(5)n[Al2(SO4)3]=0.1mol/L×0.005L=0.0005mol,n[Ba(OH)2]=0.1mol/L×0.02L=0.002mol,
n(Al3+)=2n[Al2SO4)3]=0.001mol,
n(SO4 2- )=3n[Al2(SO3)3]=0.0015mol,
n(Ba2+)=n[Ba(OH)2]=0.002mol,
n(OH-)=2n[Ba(OH)2]=0.004mol,
根据Al3++4OH-=AlO2-+2H2O、Ba2++SO4 2-=BaSO4↓知,
Al3+完全被转化为AlO2-,n(SO4 2- )<n(Ba2+),所以溶液中有钡离子剩余,且剩余n(Ba2+)=0.002mol-0.0015mol=0.0005mol<n(AlO2-)=0.001mol,
偏铝酸根离子水解导致溶液呈碱性,但水解程度较小,所以溶液中离子浓度大小顺序是c(AlO2-)>c(Ba2+)>c(OH-)>c(H+),
故答案为:c(AlO2-)>c(Ba2+)>c(OH-)>c(H+).
点评:本题考查位置结构性质的相互关系及应用,涉及离子反应的计算、盖斯定律、氧化还原反应、盐类水解等知识点,侧重考查学生对知识的综合应用能力,难点是(5)题,先根据物质之间的反应确定溶液中的溶质,再结合盐类水解分析解答,题目难度中等.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
下列离子方程式正确的是( )
| A、烧碱溶液与碳酸氢钠溶液:HCO3-+OH-=H2O+CO2↑ |
| B、氧化钠与盐酸:O2-+2H+=H2O |
| C、碳酸氢钠与稀硫酸:CO32-+2H+=H2O+CO2↑ |
| D、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
已知X、Y、Z、W、R五种元素,原子序数依次增大,且原子序数都小于20,X元素的原子是所有元素的原子中半径最小的,Y、W同主族,Z、W同周期,Y元素原子的最外层电子数是次外层的3倍,Z、R分别是同周期中金属性最强的元素.下列说法不正确的是( )
| A、沸点:X2Y>X2W |
| B、由X、Y、Z、W四种元素组成的化合物既含有共价键又含离子键 |
| C、原子半径:X<Y<Z<W<R |
| D、Y与W形成的化合物WY2是形成酸雨的主要物质之一 |
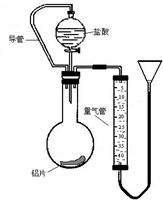 (1)在探究铝和盐酸反应的实验现象是:“向铝片滴加盐酸,开始铝片表面出现少量气泡,而且气泡越来越多,甚至于使酸液‘沸腾’起来.”请解释上述现象.
(1)在探究铝和盐酸反应的实验现象是:“向铝片滴加盐酸,开始铝片表面出现少量气泡,而且气泡越来越多,甚至于使酸液‘沸腾’起来.”请解释上述现象.

 (1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.
(1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.