题目内容
12.下列说法不正确的是( )| A. | 绿色化学的核心就是利用化学原理减少和消除工业生产对环境的污染 | |
| B. | 石油是由多种碳氢化合物组成的混合物 | |
| C. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| D. | 煤的干馏是将煤隔绝空气加强热使之分解的过程 |
分析 A.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染;
B.石油含有多种烃;
C.根据海水淡化的主要方法分析;
D.煤的干馏指煤在隔绝空气条件下加强热使之分解的过程.
解答 解:A.传统的化学工业给环境带来的污染已经十分严重,绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染,故A错误;
B.石油是由多种碳氢化合物组成的混合物,故B正确;
C.海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,故C正确;
D.煤的干馏指煤在隔绝空气条件下加强热使之分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程,故D正确.
故选A.
点评 本题考查了常见生活环境的污染及治理、海水淡化、煤的干馏的成因等知识,题目难度中等,注意掌握生活污染及治理方法,明确海水淡化的方法,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
2.在标准状况下,与12g H2的体积相等的N2( )
| A. | 质量为12g | B. | 物质的量为6mol | ||
| C. | 体积约为22.4L | D. | 分子数约为6.02×1023 |
20. 碳及其化合物有广泛的用途.
碳及其化合物有广泛的用途.
(1)甲醇常作燃料,已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则1mol 甲醇不完全燃烧生成一氧化碳和液态水时反应的△H=$\frac{1}{2}$(△H1-△H2+4△H3)kJ•mol-1.(用含△H1、△H2、△H3的式子表示)
(2)煤的综合利用煤气化是将水蒸气通过红热的碳可产生水煤气:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,能提高水煤气的生成速率的措施是AC.
A.升高温度 B.增加碳的用量 C.缩小体积 D.用CO吸收剂除去CO
(3)将一定量的C (s)和H2O(g)通过某恒容的密闭容器中发生反应,得到如下数据:
通过计算,该反应的平衡常数为:0.25.
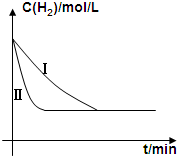
(4)工业上用水煤气来合成有机燃料,例如:CO(g)+2H2(g)$\stackrel{一定条件下}{?}$CH3OH(g)△H=-91kJ/mol某同学在不同实验条件下模拟化工生产进行实验,H2浓度随时间变化如图:
①实验I比实验II达到平衡所用的时间长.(填“长”“短”或“相等”)
②实验III比实验I的温度要高,其它条件相同,请在上图画出实验I和实验III中H2浓度随时间变化的示意图.
 碳及其化合物有广泛的用途.
碳及其化合物有广泛的用途.(1)甲醇常作燃料,已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则1mol 甲醇不完全燃烧生成一氧化碳和液态水时反应的△H=$\frac{1}{2}$(△H1-△H2+4△H3)kJ•mol-1.(用含△H1、△H2、△H3的式子表示)
(2)煤的综合利用煤气化是将水蒸气通过红热的碳可产生水煤气:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,能提高水煤气的生成速率的措施是AC.
A.升高温度 B.增加碳的用量 C.缩小体积 D.用CO吸收剂除去CO
(3)将一定量的C (s)和H2O(g)通过某恒容的密闭容器中发生反应,得到如下数据:
| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
(4)工业上用水煤气来合成有机燃料,例如:CO(g)+2H2(g)$\stackrel{一定条件下}{?}$CH3OH(g)△H=-91kJ/mol某同学在不同实验条件下模拟化工生产进行实验,H2浓度随时间变化如图:
①实验I比实验II达到平衡所用的时间长.(填“长”“短”或“相等”)
②实验III比实验I的温度要高,其它条件相同,请在上图画出实验I和实验III中H2浓度随时间变化的示意图.
7.与有机物  互为同分异构体,且能与NaOH溶液反应的化合物有( )
互为同分异构体,且能与NaOH溶液反应的化合物有( )
 互为同分异构体,且能与NaOH溶液反应的化合物有( )
互为同分异构体,且能与NaOH溶液反应的化合物有( )| A. | 9 种 | B. | 8 种 | C. | 7 种 | D. | 10 种 |
17.在一定温度下将1molCO 和3mol 水蒸气放在密闭的容器中发生下列反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol 水蒸气,达到新的平衡后,CO2和H2的物质的量之和为( )
| A. | 1.2 mol | B. | 1.5 mol | C. | 1.8 mol | D. | 2.1 mol |
1.下列对有机物结构或性质的描述,正确的是( )
| A. | 苯和氢气制环己烷;苯的硝化反应;属于同一反应类型 | |
| B. | 乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷属于同一反应类型 | |
| C. | 乙烷和丙烯混合物的物质的量为1mol,完全燃烧生成3molH2O | |
| D. | 一定条件下,乙醇可发生消去反应,甲醇也可发生消去反应 |

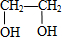 $→_{△}^{浓H_{2}SO_{4}}$ C
$→_{△}^{浓H_{2}SO_{4}}$ C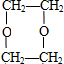 ;
;