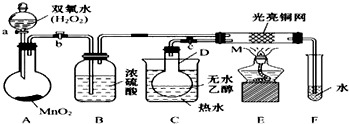
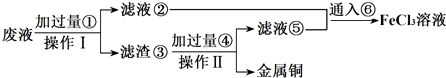
题目内容
3.H2A在水中存在以下平衡:H2A?H++HA-,HA-?H++A2-.(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-).
(2)常温时,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性.此时该混合溶液的下列关系中,一定正确的是ab.
A.c(Na+)>c(K+) B.c(H+)•c(OH-)=1×10-14
C.c(Na+)=c(K+) D.c(Na+)+c(K+)=c(HA-)+c(A2-)
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)?Ca2+(aq)+A2-(aq)
加入少量Na2A固体,c(Ca2+)减小(填“增大”、“减小”或“不变”),原因是加入Na2A固体,c(A2-)增大,从而导致溶解平衡左移,c(Ca2+)减小.
分析 (1)H2A是二元弱酸,其发生两步电离,且第一步电离程度远远大于第二步电离,NaHA溶液显酸性,说明HA-电离程度大于水解程度,钠离子不水解,再结合电荷守恒分析解答;
(2)常温时,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性,溶液中溶质为Na2A、NaHA,则c(H+)=c(OH );NaHA溶液呈碱性,要使混合溶液呈中性,n(NaHA)>n(KOH),再结合电荷守恒、物料守恒分析解答;
(3)加入Na2A固体,c(A2-)增大,抑制CaA溶解.
解答 解:(1)H2A是二元弱酸,其发生两步电离,且第一步电离程度远远大于第二步电离,NaHA溶液显酸性,说明HA-电离程度大于水解程度,且其程度都较小,钠离子不水解,HA-和水电离都生成氢离子,只有HA-电离生成A2-,所以离子浓度大小顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
(2)常温时,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性,溶液中溶质为Na2A、NaHA,则c(H+)=c(OH );NaHA溶液呈碱性,要使混合溶液呈中性,n(NaHA)>n(KOH),
a.因为n(NaHA)>n(KOH),且钠离子、钾离子都不水解,所以存在c(Na+ )>c(K+ ),故a正确;
b.离子积常数只与温度有关,温度不变,离子积常数不变,所以常温下c(H +)•c(OH )=1×10-14,故b正确;
c.根据A知c(Na+ )>c(K+ ),故c错误;
d.溶液呈中性,则c(H+)=c(OH ),结合电荷守恒得c(Na+ )+c(K+ )=c(HA- )+2c(A2-),故d错误;
故选ab;
(3)加入Na2A固体,c(A2-)增大,从而导致溶解平衡左移,c(Ca2+)减小,故答案为:减小;加入Na2A固体,c(A2-)增大,从而导致溶解平衡左移,c(Ca2+)减小.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意电荷守恒和物料守恒的灵活运用,难点是(2)NaHA、KOH物质的量相对大小判断,注意该二元酸两步电离都是部分电离的,题目难度不大.

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案| A. | 乙醇的分子式C2H5OH | B. | 硫离子的结构示意图: | ||
| C. | NH4Cl的电子式: | D. | 对氯甲苯的结构简式: |
| A. | +2 | B. | +1 | C. | 0 | D. | -1 |
| A. | 石油的炼制过程不都是化学变化 | |
| B. | 煤中含有苯和甲苯,可用蒸馏的方法将它们分离 | |
| C. | 煤是工业上获得芳香烃的一种重要原料 | |
| D. | 煤通过液化和气化处理能减少环境污染 |
| A. | 向AgCl悬浊液中加入KI溶液:AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | |
| B. | 明矾净水:Al3++3H2O?Al(OH)3+3H+ | |
| C. | 90℃时,测得纯水中Kw=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| D. | 用热的纯碱溶液可以清洗油污:CO32-+H2O?HCO3-+OH- |
| A. | 绿色化学的核心就是利用化学原理减少和消除工业生产对环境的污染 | |
| B. | 石油是由多种碳氢化合物组成的混合物 | |
| C. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| D. | 煤的干馏是将煤隔绝空气加强热使之分解的过程 |