题目内容
将钠、铝混合物W1g投入一定量水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向反应后的溶液中逐滴加入浓度为a mol?L-1的盐酸,在此过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2L,将溶液蒸干、灼烧得固体W2g.下列关系式错误的是( )
| A、35.5aV2=W2-W1 | ||
| B、23n(Na)+27n(Al)=W1 | ||
C、n(Na)+3n(Al)=
| ||
D、aV2=
|
考点:有关混合物反应的计算
专题:计算题
分析:将质量为W1g的钠、铝混合物投入一定量的水中充分反应,反应的化学方程式为:2Na+2H2O═2NaOH+H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
向溶液中加入盐酸至过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时,溶液成分是NaCl和AlCl3,将溶液蒸干并充分灼烧得到固体W2g,在蒸干并灼烧过程中发生反应为:AlCl3+3H2O═Al(OH)3+3HCl、2Al(OH)3
Al2O3+3H2O,最后得到的固体为NaCl和Al2O3,以此进行计算.
向溶液中加入盐酸至过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时,溶液成分是NaCl和AlCl3,将溶液蒸干并充分灼烧得到固体W2g,在蒸干并灼烧过程中发生反应为:AlCl3+3H2O═Al(OH)3+3HCl、2Al(OH)3
| ||
解答:
解:将质量为W1g的钠、铝混合物投入一定量的水中充分反应,反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
向溶液中加入盐酸至过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时,溶液成分是NaCl和AlCl3,将溶液蒸干并充分灼烧得到固体W2g,在蒸干并灼烧过程中发生反应为:AlCl3+3H2O═Al(OH)3+3HCl、2Al(OH)3
Al2O3+3H2O,最后得到的固体为NaCl和Al2O3,
A.根据以上分析可知,最后得到的固体为NaCl和Al2O3,根据物质的组成可知:W2-W1=m(Cl)+m(O)=35.5n(Na)+
×n(Al)×16=35.5n(Na)+24n(Al),而35.5aV2g为氯化氢中氯离子的质量,不等于m(Cl)+m(O)≠m(Cl),则35.5aV2≠W2-W1,故A错误;
B.钠、铝混合物的质量为W1g,则23n(Na)+27n(Al)=W1,故B正确;
C.将钠、铝混合物投入一定量的水中充分反应,反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知:1molNa~0.5molH2~1molH,1molAl~1.5molH2~3molH,生成H2的物质的量为
=
mol,共含有
molH,所以n(Na)+3n(Al)=
,故C正确;
D.向溶液中加入盐酸至过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时,溶液成分是NaCl和AlCl3,共消耗盐酸为aV2mol,根据NaCl和AlCl3的化学式可知n(Na)+3n(Al)=aV2;根据C可知n(Na)+3n(Al)=
,则:aV2=
,故D正确;
故选A.
向溶液中加入盐酸至过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时,溶液成分是NaCl和AlCl3,将溶液蒸干并充分灼烧得到固体W2g,在蒸干并灼烧过程中发生反应为:AlCl3+3H2O═Al(OH)3+3HCl、2Al(OH)3
| ||
A.根据以上分析可知,最后得到的固体为NaCl和Al2O3,根据物质的组成可知:W2-W1=m(Cl)+m(O)=35.5n(Na)+
| 3 |
| 2 |
B.钠、铝混合物的质量为W1g,则23n(Na)+27n(Al)=W1,故B正确;
C.将钠、铝混合物投入一定量的水中充分反应,反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知:1molNa~0.5molH2~1molH,1molAl~1.5molH2~3molH,生成H2的物质的量为
| V1L |
| 22.4L/mol |
| V1 |
| 22.4 |
| V1 |
| 11.2 |
| V1 |
| 11.2 |
D.向溶液中加入盐酸至过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时,溶液成分是NaCl和AlCl3,共消耗盐酸为aV2mol,根据NaCl和AlCl3的化学式可知n(Na)+3n(Al)=aV2;根据C可知n(Na)+3n(Al)=
| V1 |
| 11.2 |
| V1 |
| 11.2 |
故选A.
点评:本题考查混合物的计算,题目难度较大,本题注意根据反应的有关化学方程式进行计算,注意将溶液蒸干并充分灼烧得到固体W2g,最后得到的固体为NaCl和Al2O3.

练习册系列答案
相关题目
下列物质中,只含有离子键的是( )
| A、H2O |
| B、CO2 |
| C、MgCl2 |
| D、KOH |

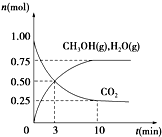 (1)科学家用H2和CO2生产甲醇燃料.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.
(1)科学家用H2和CO2生产甲醇燃料.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.