题目内容
500m L KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol?L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
①原混合溶液中c(K+)=4mol?L-1
②原混合溶液中c(K+)=2mol?L-1
③电解得到的Cu的物质的量为0.5mol
④电解后溶液中c(H+)=2mol?L-1
⑤向电解后的溶液中加入一定量的CuO可恢复为原溶液
⑥向电解后的溶液中加入一定量的Cu(OH)2可恢复为原溶液
⑦上述电解过程中共转移了4mol电子
⑧电解后溶液中c(H+)=4mol?L-1.
①原混合溶液中c(K+)=4mol?L-1
②原混合溶液中c(K+)=2mol?L-1
③电解得到的Cu的物质的量为0.5mol
④电解后溶液中c(H+)=2mol?L-1
⑤向电解后的溶液中加入一定量的CuO可恢复为原溶液
⑥向电解后的溶液中加入一定量的Cu(OH)2可恢复为原溶液
⑦上述电解过程中共转移了4mol电子
⑧电解后溶液中c(H+)=4mol?L-1.
| A、②⑥⑦⑧ | B、①④⑤⑦ |
| C、②⑤⑦⑧ | D、①③④⑥ |
考点:电解原理
专题:化学反应中的能量变化
分析:石墨作电极电解此溶液时,阳极发生的反应为:4OH--4e-═O2↑+2H2O,阴极上发生的电极反应为:Cu2++2e-═Cu,2H++2e-═H2↑,
两极均收集到22.4L(标况)气体,n=
=1mol,即均生成1mol的气体,阳极生成1mol氧气说明转移了4mol电子,而阴极上生成的1molH2只得到了2mol电子,所以剩余2mol电子由铜离子获得,且溶液中有1molCu2+,再根据溶液为电中性,遵循电荷守恒可得钾离子物质的量浓度,从该溶液中析出Cu、H2、O2,
所以电解后加入一定量的Cu(OH)2可恢复为原溶液,根据以上分析结合电子守恒及物质的量浓度的计算来解答.
两极均收集到22.4L(标况)气体,n=
| 22.4L |
| 22.4L/mol |
所以电解后加入一定量的Cu(OH)2可恢复为原溶液,根据以上分析结合电子守恒及物质的量浓度的计算来解答.
解答:
解:石墨作电极电解此溶液,阳极发生的反应为:4OH--4e-═O2↑+2H2O,阴极上发生的电极反应为:Cu2++2e-═Cu,2H++2e-═H2↑,
当通电一段时间后,两极均收集到22.4L气体(标准状况),n=
=1mol,
阳极发生4OH--4e-═O2↑+2H2O,
4mol 4mol 1mol
阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
1mol 2mol 1mol 2mol 2mol 1mol
①c(Cu2+)=
=2mol/L,由电荷守恒可得c(K+)=6mol?L-1-2mol/L×2=2mol/L,故①错误;
②根据①分析,c(K+)=2mol/L,故②正确;
③根据以上分析知,析出铜的物质的量为1mol,故③错误;
④电解后溶液中c(H+)为
=4mol/L,故④错误;
⑤从该溶液中析出Cu、H2、O2,所以电解后加入一定量的Cu(OH)2可恢复为原溶液,故⑤错误;
⑥根据⑤分析可知,电解后加入一定量的Cu(OH)2可恢复为原溶液,故⑥正确;
⑦生成1mol氧气需要转移电子4mol,所以上述电解过程中共转移了4mol电子,故⑦正确;
⑧电解后溶液中c(H+)为
=4mol/L,故⑧正确;
故选A.
当通电一段时间后,两极均收集到22.4L气体(标准状况),n=
| 22.4L |
| 22.4L/mol |
阳极发生4OH--4e-═O2↑+2H2O,
4mol 4mol 1mol
阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
1mol 2mol 1mol 2mol 2mol 1mol
①c(Cu2+)=
| 1mol |
| 0.5L |
②根据①分析,c(K+)=2mol/L,故②正确;
③根据以上分析知,析出铜的物质的量为1mol,故③错误;
④电解后溶液中c(H+)为
| 4mol-2mol |
| 0.5L |
⑤从该溶液中析出Cu、H2、O2,所以电解后加入一定量的Cu(OH)2可恢复为原溶液,故⑤错误;
⑥根据⑤分析可知,电解后加入一定量的Cu(OH)2可恢复为原溶液,故⑥正确;
⑦生成1mol氧气需要转移电子4mol,所以上述电解过程中共转移了4mol电子,故⑦正确;
⑧电解后溶液中c(H+)为
| 4mol-2mol |
| 0.5L |
故选A.
点评:本题考查电解原理,明确发生的电极反应及电子守恒是解答本题的关键,题目难度中等,选项⑤为学生解答的难点,注意该溶液中析出Cu、H2、O2,电解后加入一定量的Cu(OH)2可恢复为原溶液.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
下列变化过程,属于放热过程的是( )
①液态水变成水蒸气
②酸碱中和反应
③浓H2SO4稀释
④固体氢氧化钠溶于水
⑤H2在Cl2中燃烧
⑥弱酸电离
⑦NH4Cl晶体与Ba(OH)2?8H2O混合搅拌.
①液态水变成水蒸气
②酸碱中和反应
③浓H2SO4稀释
④固体氢氧化钠溶于水
⑤H2在Cl2中燃烧
⑥弱酸电离
⑦NH4Cl晶体与Ba(OH)2?8H2O混合搅拌.
| A、②③④ | B、①⑥⑦ |
| C、①③⑤ | D、②③④⑤ |
下列有关物质的性质和该性质的应用均正确的是( )
| A、晶体硅具有半导体性质,可用于生产光导纤维 |
| B、H2O2是一种绿色氧化剂,可与酸性高锰酸钾作用产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、二氧化硫具有漂白性,铵不可用于食品漂白 |
将钠、铝混合物W1g投入一定量水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向反应后的溶液中逐滴加入浓度为a mol?L-1的盐酸,在此过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2L,将溶液蒸干、灼烧得固体W2g.下列关系式错误的是( )
| A、35.5aV2=W2-W1 | ||
| B、23n(Na)+27n(Al)=W1 | ||
C、n(Na)+3n(Al)=
| ||
D、aV2=
|
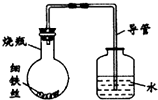 某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.