题目内容
某化学兴趣小组要完成中和热的测定.实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol?L-1盐酸、0.55mol?L-1 NaOH溶液,
(1)实验尚缺少的玻璃用品是 、 .
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 .
(3)他们记录的实验数据如下:
已知:Q=
cm,反应后溶液的比热容c为4.18kJ?℃-1?kg-1,各物质的密度均为1g?cm-3.
根据实验计算结果写出NaOH溶液与HCl溶液反应的热化学方程式: .
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响.
(1)实验尚缺少的玻璃用品是
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(3)他们记录的实验数据如下:
| 实验用品 | 溶液 体积* | 溶液温度 | 中和热(△H) | ||
| t1 | t2 | ||||
| a | 0.55 mol?L-1 NaOH溶液 | 50 mL | 20℃ | 23.3℃ | |
| 0.5 mol?L-1 HCl溶液 | 50 mL | ||||
| b | 0.55 mol?L-1 NaOH溶液 | 50 mL | 20℃ | 23.5℃ | |
| 0.5 mol?L-1 HCl 溶液 | 50 mL | ||||
. |
| △t |
根据实验计算结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果
考点:中和热的测定
专题:实验题
分析:(1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(2)金属导热快,热量损失多;
(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
kJ/mol计算出反应热,根据中和热的概念以及热化学方程式的书写方法写出热化学方程式;
(4)根据中和热的概念分析,弱电解质电离吸热;
(2)金属导热快,热量损失多;
(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
| Q |
| n |
(4)根据中和热的概念分析,弱电解质电离吸热;
解答:
解:(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少温度计和量筒,
故答案为:量筒;温度计;
(2)不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,热量损失大,
故答案为:否;Cu易导热,热量散失导致误差大;
(3)2次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值=3.4℃,50mL0.55mol?L-1NaOH和50mL.0.5mol?L-1HCl质量和为m=100mL×1g/mL=100g,c=4.18J/(g?℃),△T=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g?℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为
=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,NaOH溶液与HCl溶液反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol,
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol;
(4)在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热,若用KOH代替NaOH,测定结果无影响,醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替HCl做实验,反应放出的热量小于56.8kJ,测定结果偏小,对测定结果有影响,
故答案为:无;有;
故答案为:量筒;温度计;
(2)不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,热量损失大,
故答案为:否;Cu易导热,热量散失导致误差大;
(3)2次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值=3.4℃,50mL0.55mol?L-1NaOH和50mL.0.5mol?L-1HCl质量和为m=100mL×1g/mL=100g,c=4.18J/(g?℃),△T=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g?℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为
| 1.4212KJ×1mol |
| 0.025mol |
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol;
(4)在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热,若用KOH代替NaOH,测定结果无影响,醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替HCl做实验,反应放出的热量小于56.8kJ,测定结果偏小,对测定结果有影响,
故答案为:无;有;
点评:本题考查中和热的测定,题目难度不大,注意理解中和热的概念以及热化学方程式的书写,理解中和热测定原理是解答关键,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列用AlCl3制取纯净的Al(NO3)3的方法中,最佳的是( )
| A、用AlCl3与纯HNO3反应 |
| B、用AlCl3溶液与Ba(NO3)2溶液反应 |
| C、用AlCl3溶液与NaOH反应,过滤得沉淀再加HNO3 |
| D、用AlCl3溶液与氨水反应,过滤得沉淀再加HNO3 |
下列分子中所有原子都满足最外层8电子结构的是( )
| A、NH3 |
| B、PCl5 |
| C、COCl2 |
| D、BF3 |
下列推断正确的是( )
| A、明矾是一种复盐,则NaAlO2也是一种复盐 |
| B、CaCO3的溶解度小于Ca(HCO3)2,则Na2CO3的溶解度小于NaHCO3 |
| C、在Ca(ClO)2溶液中分别通入CO2、SO2,前者生成CaCO3沉淀,则后者也生成CaSO3沉淀 |
| D、S、Cl两种元素为同周期元素,H2SO4为强酸,则HClO4也为强酸 |
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )| A、原子半径:Q>T>R |
| B、最高价氧化物对应水化物的酸性:Q<W |
| C、气态氢化物的稳定性:R>Q |
| D、Q的氧化物只能与碱反应 |
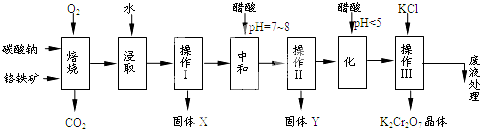
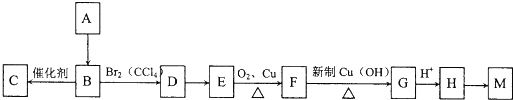
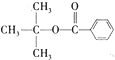 ),注:部分物质省略.
),注:部分物质省略.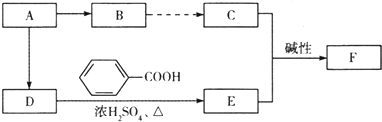

 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.