题目内容
 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.请回答下列问题:
(1)这四种元素中电负性最大的是
(2)C所在的主族元素气态氢化物中,沸点最低的是
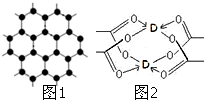
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图1所示,其原子的杂化类型为
(4)D的醋酸盐晶体局部结构如图2,该晶体中含有的化学键是
①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:
D单质
| 氯气,点燃 |
| ① |
| 少量水 |
| ② |
| 氨气 |
| ③ |
| 氨气 |
| ④ |
| H2S |
| ⑤ |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;B与C可形成正四面体型分子,则B为氯元素;D原子外围电子排布为3d104s1,则D为铜元素.
(1)非金属性越强,电负性越大;金属性越强,第一电离能越小;
(2)HF中存在氢键,沸点比HCl高,其它氢化物相对分子质量越大,沸点越高;
(3)在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化;
(4)由结构图可知,该晶体中含有C-H键、C-C键、配位键;
(5)由关系图可知,加氨水生成的蓝色沉淀为氢氧化铜,再加氨水生成的蓝色溶液为四氨合铜络离子,蓝色溶液通入硫化氢,生成的黑色沉淀为硫化铜.
(1)非金属性越强,电负性越大;金属性越强,第一电离能越小;
(2)HF中存在氢键,沸点比HCl高,其它氢化物相对分子质量越大,沸点越高;
(3)在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化;
(4)由结构图可知,该晶体中含有C-H键、C-C键、配位键;
(5)由关系图可知,加氨水生成的蓝色沉淀为氢氧化铜,再加氨水生成的蓝色溶液为四氨合铜络离子,蓝色溶液通入硫化氢,生成的黑色沉淀为硫化铜.
解答:
解:原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;B与C可形成正四面体型分子,则B为氯元素;D原子外围电子排布为3d104s1,则D为铜元素.
(1)氯元素非金属性最强,电负性越大;铜为金属,其它为非金属,所以铜第一电离能最小,
故答案为:Cl;Cu;
(2)HF中存在氢键,沸点比HCl高,其它氢化物相对分子质量越大,沸点越高,所以HCl的沸点最低.
故答案为:HCl;
(3)在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化,3个杂化轨道用来形成σ键结合其他碳原子,所有碳原子剩余2p轨道一同形成离域大π键,
故答案为:sp2;
(4)由结构图可知,该晶体中含有C-H键为极性键、C-C键为非极性键、配位键,
故选:①②③;
(5)由关系图可知,加氨水生成的蓝色沉淀为氢氧化铜,再加氨水生成的蓝色溶液为四氨合铜络离子,蓝色溶液通入硫化氢,生成硫化铜、铵根离子、一水合氨,反应离子方程式为[Cu(NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3?H2O,
故答案为:[Cu(NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3?H2O.
(1)氯元素非金属性最强,电负性越大;铜为金属,其它为非金属,所以铜第一电离能最小,
故答案为:Cl;Cu;
(2)HF中存在氢键,沸点比HCl高,其它氢化物相对分子质量越大,沸点越高,所以HCl的沸点最低.
故答案为:HCl;
(3)在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化,3个杂化轨道用来形成σ键结合其他碳原子,所有碳原子剩余2p轨道一同形成离域大π键,
故答案为:sp2;
(4)由结构图可知,该晶体中含有C-H键为极性键、C-C键为非极性键、配位键,
故选:①②③;
(5)由关系图可知,加氨水生成的蓝色沉淀为氢氧化铜,再加氨水生成的蓝色溶液为四氨合铜络离子,蓝色溶液通入硫化氢,生成硫化铜、铵根离子、一水合氨,反应离子方程式为[Cu(NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3?H2O,
故答案为:[Cu(NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3?H2O.
点评:本题是对物质结构的考查,题目比较综合,涉及元素推断、核外电子排布规律、晶体结构与化学键、配合物等,难度中等,是对学生综合能力的考查,学习中注重相关基础的积累.

练习册系列答案
相关题目
下列分子中所有原子都满足8电子稳定结构的是( )
| A、HClO |
| B、Na2O2 |
| C、BF3 |
| D、PCl5 |
下列分子中各原子最外层均达到8电子稳定结构的是( )
| A、SCl2、PCl3、CO2 |
| B、AsH3、BF3、BeCl2 |
| C、XeF2、PCl5、ClO2 |
| D、H2SO3、CO2、BrF3 |
中共十八大提出“生态文明”的新理念.下列做法不符合该理念的是( )
| A、研发可降解高分子材料,减少塑料制品的使用 |
| B、倡导“低碳经济”,减少对化石燃料的依赖 |
| C、通过“静电除尘”、“燃煤固硫”和“汽车尾气催化净化”提高空气质量 |
| D、采用露天焚烧或深埋的方法处理所有垃圾 |
某有机物结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A、该有机物分子式为:C10H8O6 |
| B、分子中最多有9个碳原子共平面 |
| C、该有机物可发生取代反应、还原反应,不能发生银镜反应 |
| D、1 mol该有机物分别与足量Na、NaOH溶液、NaHCO3溶液完全反应,消耗Na、NaOH、NaHCO3的物质的量分别为3mol、4mol、1 mol |