题目内容
下列用AlCl3制取纯净的Al(NO3)3的方法中,最佳的是( )
| A、用AlCl3与纯HNO3反应 |
| B、用AlCl3溶液与Ba(NO3)2溶液反应 |
| C、用AlCl3溶液与NaOH反应,过滤得沉淀再加HNO3 |
| D、用AlCl3溶液与氨水反应,过滤得沉淀再加HNO3 |
考点:镁、铝的重要化合物,制备实验方案的设计
专题:元素及其化合物
分析:根据复分解反应的条件以及氢氧化铝的两性进行判断和分析;
A、AlCl3与纯HNO3不反应;
B、AlCl3溶液与Ba(NO3)2溶液不反应;
C、用AlCl3溶液与NaOH反应,但由于氢氧化铝具有两性,它能继续与氢氧化钠反应,所以制得的氢氧化铝量少,故而过滤得沉淀再加HNO3反应得到的硝酸铝量也少;
D、用AlCl3溶液与氨水反应,由于氢氧化铝的两性,只能与强酸强碱反应,所以它不能继续与氨水反应,所以制得的氢氧化铝量多,故而过滤得沉淀再加HNO3反应得到的硝酸铝的量也多.
A、AlCl3与纯HNO3不反应;
B、AlCl3溶液与Ba(NO3)2溶液不反应;
C、用AlCl3溶液与NaOH反应,但由于氢氧化铝具有两性,它能继续与氢氧化钠反应,所以制得的氢氧化铝量少,故而过滤得沉淀再加HNO3反应得到的硝酸铝量也少;
D、用AlCl3溶液与氨水反应,由于氢氧化铝的两性,只能与强酸强碱反应,所以它不能继续与氨水反应,所以制得的氢氧化铝量多,故而过滤得沉淀再加HNO3反应得到的硝酸铝的量也多.
解答:
解:A、AlCl3与纯HNO3不反应,故A错误;
B、AlCl3溶液与Ba(NO3)2溶液不反应,故B错误;
C、用AlCl3溶液与NaOH反应,但由于氢氧化铝具有两性,它能继续与氢氧化钠反应,所以制得的氢氧化铝量少,故而过滤得沉淀再加HNO3反应得到的硝酸铝量也少,故C不是最佳,故C错误;
D、用AlCl3溶液与氨水反应,由于氢氧化铝的两性,只能与强酸强碱反应,所以它不能继续与氨水反应,所以制得的氢氧化铝量多,故而过滤得沉淀再加HNO3反应得到的硝酸铝的量也多,故D是最佳,故D正确;
故选:D.
B、AlCl3溶液与Ba(NO3)2溶液不反应,故B错误;
C、用AlCl3溶液与NaOH反应,但由于氢氧化铝具有两性,它能继续与氢氧化钠反应,所以制得的氢氧化铝量少,故而过滤得沉淀再加HNO3反应得到的硝酸铝量也少,故C不是最佳,故C错误;
D、用AlCl3溶液与氨水反应,由于氢氧化铝的两性,只能与强酸强碱反应,所以它不能继续与氨水反应,所以制得的氢氧化铝量多,故而过滤得沉淀再加HNO3反应得到的硝酸铝的量也多,故D是最佳,故D正确;
故选:D.
点评:本题以硝酸铝的制备为载体,考查铝的重要化合物的性质,难度不大,注意题目要求意在考查氢氧化铝的两性这一特性.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
不用试剂只用试管和滴管不能鉴别下列无色溶液的是( )
| A、碳酸钠溶液和稀硫酸 |
| B、氯化铝溶液和氢氧化钠溶液 |
| C、四羟基合铝酸钠溶液和稀盐酸 |
| D、氯化钡溶液和碳酸钠溶液 |
2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的主要反应之一.一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示下列判断中,正确的是( )
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | |
| A、乙中SO2的平衡转化率大于80% |
| B、该温度下,乙达平衡时间小于甲 |
| C、平衡时,丙中c(SO3)是甲中的2倍 |
| D、平衡时,甲中O2的转化率大于乙中O2的转化率 |
下列分子中各原子最外层均达到8电子稳定结构的是( )
| A、SCl2、PCl3、CO2 |
| B、AsH3、BF3、BeCl2 |
| C、XeF2、PCl5、ClO2 |
| D、H2SO3、CO2、BrF3 |
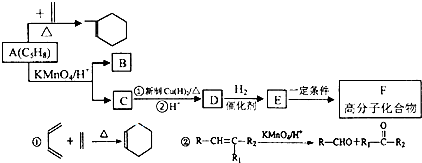
 时,A发生的反应类型为
时,A发生的反应类型为