题目内容
 (1)已知3O2(g)?2O3(g)△H=+142.7kJ/mol,在一定条件下达平衡,下列可使
(1)已知3O2(g)?2O3(g)△H=+142.7kJ/mol,在一定条件下达平衡,下列可使| C(O3) |
| C(O2) |
A.升高体系温度
B.恒温恒容下又充入一定量O2
C.恒温恒压下又充入一定量O2
D.恒温恒压下充入一定量惰性气体He
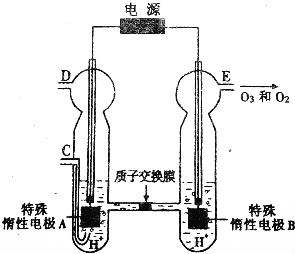
(2)O3可由臭氧发生器(原理如图)电解稀硫酸制得
①如图中阴极
②若C处通入O2,则A极的电极反应式为
③若C处不通入O2,D、E处分别收集到x L和有y L气体(标准情况),则E处收集气体中O3所占的体积分数为
考点:电解原理,化学平衡的影响因素
专题:
分析:(1)在一定条件下达平衡,下列可使
比值增大,应使平衡向正向移动;
(2)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极;
②C处通入O2,O2发生还原反应,在酸性条件下生成水;
③若C处不通入O2,实质为电解水,D处为氢气,体积为x L,E处为氧气、臭氧,体积共为yL,令臭氧的体积为ZL,利用电子转移守恒列放出计算Z的值,再根据体积分数定义计算.
| C(O3) |
| C(O2) |
(2)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极;
②C处通入O2,O2发生还原反应,在酸性条件下生成水;
③若C处不通入O2,实质为电解水,D处为氢气,体积为x L,E处为氧气、臭氧,体积共为yL,令臭氧的体积为ZL,利用电子转移守恒列放出计算Z的值,再根据体积分数定义计算.
解答:
解:(1)A.升高体系温度,因正反应放热,则平衡向正向移动,则可使
比值增大,故A正确;
B.恒温恒容下又充入一定量O2 ,可等效于直接增大压强,则平衡正向移动,则可使
比值增大,故B正确;
C.恒温恒压下又充入一定量O2 ,平衡常数不变,浓度不变,则
比值不变,故C错误;
D.恒温恒压下充入一定量惰性气体He,体积增大,相当于减小压强(分压),平衡逆向移动,则可使
比值减小,故D错误.
故答案为:AB;
(2)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-═H2↑,故答案为:A;2H++2e-═H2↑;
②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
③若C处不通入O2,实质为电解水,D处为氢气,体积为x L,E处为氧气、臭氧,体积共为y L,令臭氧的体积为ZL,根据电子转移守恒有x×2=Z×3×2+(y-Z)×2×2,解得Z=x-2y,所以E处收集的气体中O3所占的体积分数为
,
故答案为:
.
| C(O3) |
| C(O2) |
B.恒温恒容下又充入一定量O2 ,可等效于直接增大压强,则平衡正向移动,则可使
| C(O3) |
| C(O2) |
C.恒温恒压下又充入一定量O2 ,平衡常数不变,浓度不变,则
| C(O3) |
| C(O2) |
D.恒温恒压下充入一定量惰性气体He,体积增大,相当于减小压强(分压),平衡逆向移动,则可使
| C(O3) |
| C(O2) |
故答案为:AB;
(2)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-═H2↑,故答案为:A;2H++2e-═H2↑;
②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
③若C处不通入O2,实质为电解水,D处为氢气,体积为x L,E处为氧气、臭氧,体积共为y L,令臭氧的体积为ZL,根据电子转移守恒有x×2=Z×3×2+(y-Z)×2×2,解得Z=x-2y,所以E处收集的气体中O3所占的体积分数为
| x-2y |
| y |
故答案为:
| x-2y |
| y |
点评:本题考查较为综合,涉及化学平衡移动以及原电池与电解池反应原理,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,本题注意电极反应式的书写是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目