题目内容
某铝合金中含有镁、铜,为了测定合金中铝的含量,某研究性学习小组设计了如下步骤:①取该样品a克,将样品溶于足量的氢氧化钠中,过滤;②往第①步的滤液中通入足量的CO2,产生白色沉淀,过滤;③将沉淀用蒸馏水洗涤后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为b克.
回答下列问题:
(1)写出镁原子结构示意图 .
(2)步骤①所发生反应的离子方程式 .氢氧化钠溶液需要足量的原因是 .
(3)第③步灼烧过程中可在下列哪种仪器中进行 .
A.烧杯 B.试管 C.坩埚 D.蒸发皿
(4)合金中铝的质量分数为 .
回答下列问题:
(1)写出镁原子结构示意图
(2)步骤①所发生反应的离子方程式
(3)第③步灼烧过程中可在下列哪种仪器中进行
A.烧杯 B.试管 C.坩埚 D.蒸发皿
(4)合金中铝的质量分数为
考点:探究物质的组成或测量物质的含量,常见金属元素的单质及其化合物的综合应用
专题:实验探究和数据处理题
分析:(1)根据镁原子是12个电子,最外层电子为2,结合原子结构写出示意图;
(2)根据过量的碱与Al反应生成AlO2-和氢气,氢氧化铝是两性氢氧化物溶于强酸强碱溶液中分析;
(3)依据固体灼烧所需要的仪器分析,在坩埚中加热,坩埚放在泥三角和铁三角上,用酒精灯加热,取用坩埚用坩埚钳;
(4)根据铝守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,最后求出铝的质量分数.
(2)根据过量的碱与Al反应生成AlO2-和氢气,氢氧化铝是两性氢氧化物溶于强酸强碱溶液中分析;
(3)依据固体灼烧所需要的仪器分析,在坩埚中加热,坩埚放在泥三角和铁三角上,用酒精灯加热,取用坩埚用坩埚钳;
(4)根据铝守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,最后求出铝的质量分数.
解答:
解:(1)镁原子是12个电子,最外层电子为2,镁原子结构示意图为:
故答案为: ;
;
(2)步骤①所发生反应,取该样品a克,将样品溶于足量的氢氧化钠中生成偏铝酸钠溶于和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;氢氧化钠溶液需要足量是利用氢氧化铝溶于强碱溶液,镁、铜不与氢氧化钠溶液反应,使Al全部反应溶解生成AlO2-离子;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑,使Al全部反应溶解生成AlO2-离子;
(3)固体灼烧所需要的仪器分析,在坩埚中加热,坩埚放在泥三角和铁三角上,用酒精灯加热,取用坩埚用坩埚钳,因灼烧过程中需要的仪器有:坩埚、坩埚钳、酒精灯、泥三角、三脚架等,故答案为:C.
(4)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为
bg×
=
g,所以样品中铝的质量分数为:
×100%=
×100%
故答案为:
×100%;

故答案为:
 ;
;(2)步骤①所发生反应,取该样品a克,将样品溶于足量的氢氧化钠中生成偏铝酸钠溶于和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;氢氧化钠溶液需要足量是利用氢氧化铝溶于强碱溶液,镁、铜不与氢氧化钠溶液反应,使Al全部反应溶解生成AlO2-离子;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑,使Al全部反应溶解生成AlO2-离子;
(3)固体灼烧所需要的仪器分析,在坩埚中加热,坩埚放在泥三角和铁三角上,用酒精灯加热,取用坩埚用坩埚钳,因灼烧过程中需要的仪器有:坩埚、坩埚钳、酒精灯、泥三角、三脚架等,故答案为:C.
(4)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为
bg×
| 27×2 |
| 27×2+16×3 |
| 54b |
| 102 |
| ||
| ag |
| 54b |
| 102a |
故答案为:
| 54b |
| 102a |
点评:本题考查了物质分离的方法和实验过程分析判断,主要是对于NaAlO2与CO2的化学反应方程式,有过量和少量之分,物质性质是解题关键,题目较简单.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
金属Na放到下列稀溶液中时,既有气体,又有沉淀产生的是( )
| A、Ca(HCO3)2溶液 |
| B、KCl溶液 |
| C、Na2SO4溶液 |
| D、NH4Cl溶液 |


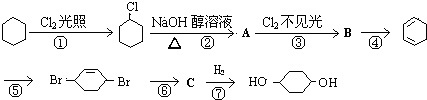

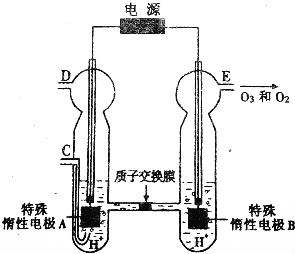 (1)已知3O2(g)?2O3(g)△H=+142.7kJ/mol,在一定条件下达平衡,下列可使
(1)已知3O2(g)?2O3(g)△H=+142.7kJ/mol,在一定条件下达平衡,下列可使