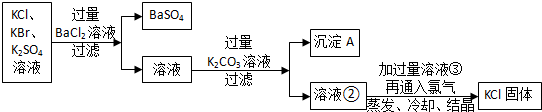
题目内容
有五种短周期主族元素A、B、C、D、E,已知:五种元素原子序数依次增大,其中A、E的单质在常温下是气体,B元素原子的最外层电子数是电子层数的2倍,D元素的单质常用于野外焊接铁轨,C元素是所在周期主族元素中原子半径最大的一种.
(1)试写出A、B两种元素形成的不含有非极性键的化合物的电子式: ;
(2)试写D单质与NaOH溶液反应的化学方程式 ;
(3)写出C单质在空气中燃烧的化学方程式,并标出电子转移的方向和数目: ;
(4)写出实验室制取单质E的化学方程式: .
(1)试写出A、B两种元素形成的不含有非极性键的化合物的电子式:
(2)试写D单质与NaOH溶液反应的化学方程式
(3)写出C单质在空气中燃烧的化学方程式,并标出电子转移的方向和数目:
(4)写出实验室制取单质E的化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:五种短周期主族元素A、B、C、D、E,原子序数依次增大,D元素的单质常用于野外焊接铁轨,则D为铝元素,C元素所在是所在周期主族元素中原子半径最大的一种,则C为第ⅠA族元素,B元素原子的最外层电子数是电子层数的2倍,则B为碳元素或者硫元素,由于原子序数小于C,所以B为碳元素,C的原子序数小于D,同C为钠元素,A、E的单质在常温下是气体,则A为氢元素,E为氯元素,据此解答各小题即可.
解答:
解:依据分析可知:A为氢,B为碳,C为钠,D为铝,E为氯,
(1)由C、H两种元素形成的不含有非极性键的化合物为甲烷,它的电子式为 ,故答案为:
,故答案为: ;
;
(2)铝与氢氧化钠反应生成偏铝酸钠和水,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)钠在空气中燃烧生成过氧化钠,反应的化学方程式及电子转移的方向和数目为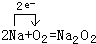 ,故答案为:
,故答案为: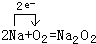 ;
;
(4)实验室用二氧化锰氧化浓盐酸制取氯气,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.
(1)由C、H两种元素形成的不含有非极性键的化合物为甲烷,它的电子式为
 ,故答案为:
,故答案为: ;
;(2)铝与氢氧化钠反应生成偏铝酸钠和水,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)钠在空气中燃烧生成过氧化钠,反应的化学方程式及电子转移的方向和数目为
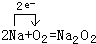 ,故答案为:
,故答案为: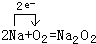 ;
;(4)实验室用二氧化锰氧化浓盐酸制取氯气,反应的化学方程式为:MnO2+4HCl(浓)
| ||
| ||
点评:本题主要考查了电子式、部分元素化合物知识、氧化还原反应等知识,中等难度,解题关键在于根据元素周期表和原子结构确定元素种类.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
下列实验操作中错误的是( )
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时应将溶液蒸干 |
| D、用固体NaOH配制一定物质的量浓度的NaOH溶液时,NaOH溶于水后,应冷却至室温才能转移到容量瓶中 |
下列反应中符合下列图象的是( )
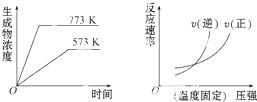

| A、N2(g)+3H2(g)?2NH5(g)△H=-Q1kJ?mol-1(Q1>0) |
| B、2SO5(g)?2SO2(g)+O2(g)△H=+Q2kJ?mol-1(Q2>0) |
| C、4NH5(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q3kJ?mol-1(Q3>0) |
| D、H2(g)+CO(g)?C(g)+H2O(g)△H=+Q4kJ?mol-1(Q4>0) |
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:下列有关香叶醇的叙述正确的是( )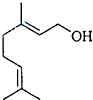

| A、香叶醇的分子式为C10H20O |
| B、不能使溴的四氯化碳溶液褪色 |
| C、不能发生催化氧化反应生成醛 |
| D、既能发生加成反应又能发生取代反应 |
 (1)已知3O2(g)?2O3(g)△H=+142.7kJ/mol,在一定条件下达平衡,下列可使
(1)已知3O2(g)?2O3(g)△H=+142.7kJ/mol,在一定条件下达平衡,下列可使