题目内容
有A、B、C、D四种元素,其原子序数大小关系为A>B>C>D.已知:将0.5mol A元素的最高价离子还原成中性原子时,需得到6.02×1023个电子.当A的单质同盐酸充分反应放出0.02g氢气时,用去0.4g A单质.B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大.C元素形成的氧化物既能溶于强酸,也能溶于强碱.D元素与氢元素生成的化合物的化学式为DH3,其最高价氧化物中氧元素的质量分数为74.07%.试回答:
(1)元素符号:A ,B ,C ,D .
(2)鉴定某物质中含有B元素的最简单的实验是 .
(3)A、B、C三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是 (用化学式表示).
(1)元素符号:A
(2)鉴定某物质中含有B元素的最简单的实验是
(3)A、B、C三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种元素,其原子序数大小关系为A>B>C>D,将0.5mol某元素A原子的最高价离子还原成中性原子时,需得到6.02×1023个电子,说明A显+2价,当A的单质同盐酸充分反应放出0.02g氢气时,则需A为0.01mol,而此时用去A单质的质量为0.4g,则A的摩尔质量为M=
=
g/mol=40g/mol,所以A为钙元素,B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大,说明原子序数小于钙,则B为钾元素,C元素的氧化物既溶于强酸,也溶于强碱,则C为铝元素,D元素与氢元素生成的化合物的化学式为DH3,R的最高价氧化物的化学式R2O5,其最高价氧化物中氧元素的质量分数为74.07%,则D为氮元素,据此答题;
(1)根据以上分析将1 mol A离子被还原,需得到2 mol电子,则A离子为A2+.由0.4 g A与盐酸充分反应生成氢气0.02 g,可知Ar(A)=40,A为钙,B、C、D分别为K、Al、N;
(2)B为K元素,碱金属元素通常用焰色反应检验;
(3)金属性越强最高价氧化物对应水化物的碱性越强.
| m |
| n |
| 0.4 |
| 0.01 |
(1)根据以上分析将1 mol A离子被还原,需得到2 mol电子,则A离子为A2+.由0.4 g A与盐酸充分反应生成氢气0.02 g,可知Ar(A)=40,A为钙,B、C、D分别为K、Al、N;
(2)B为K元素,碱金属元素通常用焰色反应检验;
(3)金属性越强最高价氧化物对应水化物的碱性越强.
解答:
解:(1)A、B、C、D四种元素,其原子序数大小关系为A>B>C>D,将0.5mol某元素A原子的最高价离子还原成中性原子时,需得到6.02×1023个电子,说明A显+2价,当A的单质同盐酸充分反应放出0.02g氢气时,则需A为0.01mol,而此时用去A单质的质量为0.4g,则A的摩尔质量为M=
=
g/mol=40g/mol,所以A为钙元素,B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大,说明原子序数小于钙,则B为钾元素,C元素的氧化物既溶于强酸,也溶于强碱,则C为铝元素,D元素与氢元素生成的化合物的化学式为DH3,R的最高价氧化物的化学式R2O5,其最高价氧化物中氧元素的质量分数为74.07%,设R的式量为R,则
=74.07%,R=14,则D为氮元素,
故答案为:Ca;K;Al;N;
(2)B为K元素,用稀盐酸洗净铂丝,置酒精灯火焰上灼烧,将铂丝蘸浓盐酸在无色火焰上灼烧至无色,蘸取试样在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色呈紫色为钾元素,
故答案为:焰色反应;
(3)金属性K>Ca>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则A、B、C三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是KOH>Ca(OH)2>Al(OH)3,
故答案为:KOH>Ca(OH)2>Al(OH)3.
| m |
| n |
| 0.4 |
| 0.01 |
| 16×5 |
| 2R+16×5 |
故答案为:Ca;K;Al;N;
(2)B为K元素,用稀盐酸洗净铂丝,置酒精灯火焰上灼烧,将铂丝蘸浓盐酸在无色火焰上灼烧至无色,蘸取试样在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色呈紫色为钾元素,
故答案为:焰色反应;
(3)金属性K>Ca>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则A、B、C三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是KOH>Ca(OH)2>Al(OH)3,
故答案为:KOH>Ca(OH)2>Al(OH)3.
点评:本题主要考查元素及其化合物知识,题目难度中等,解题关键在于元素的推断,解题时注意熟记常见物质的性质,把握规律性知识的应用.

练习册系列答案
相关题目
 有机物A、B、C、D、E都是常见的有机物,能发生如图所示的转化,已知A的分子式为C10H20O2,则符合此转化关系的A的可能结构有( )
有机物A、B、C、D、E都是常见的有机物,能发生如图所示的转化,已知A的分子式为C10H20O2,则符合此转化关系的A的可能结构有( )| A、2种 | B、3种 | C、4种 | D、5种 |
下列化学实验操作或事故处理犯法不正确的是( )
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将碱液沾带皮肤上,要立即用大量水冲洗,然后涂上硼酸 |
| C、酒精灯着火时,用湿抹布盖灭 |
| D、稀释浓硫酸时,可向盛浓硫酸的烧杯中小心注入蒸馏水,边加边搅拌 |



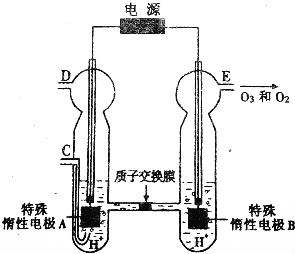 (1)已知3O2(g)?2O3(g)△H=+142.7kJ/mol,在一定条件下达平衡,下列可使
(1)已知3O2(g)?2O3(g)△H=+142.7kJ/mol,在一定条件下达平衡,下列可使