题目内容
19.自然界各种原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,并向深部渗透时,遇到闪锌矿(ZnS)和方铅矿(PbS),便慢慢地转变为铜蓝(CuS),下列有关该过程的解释及说法不合理的是( )| A. | 原生铜的硫化物具有还原性 | |
| B. | 常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水 | |
| C. | 铜蓝的形成过程是:ZnS(S)+Cu2+?CuS(S)+Zn2+ | |
| D. | 硝酸型酸雨不利于铜蓝的形成:CuS+2H+═Cu2++H2S↑ |
分析 透到地下深层的硫酸铜溶液遇到闪锌矿,在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物,硫化铜溶解性小于硫化锌,发生沉淀转化反应,离子方程式:Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq),CuS中S元素化合价为-2价,具有还原性,以此解答该题.
解答 解:A.CuS中S元素化合价为-2价,具有还原性,故A正确;
B.由题目信息可知常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水,故B正确;
C.CuS溶解度较小,发生沉淀转化反应,离子方程式:Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq),故C正确;
D.硝酸具有氧化性,发生氧化还原反应不能生成硫化氢,故D错误.
故选D.
点评 本题考查铜及其化合物的知识,为高频考点,侧重于学生的分析能力的考查,涉及难溶电解质的转化问题,注意把握物质的性质以及题给信息的获取,难度不大.

练习册系列答案
相关题目
10.用Na2SO3溶液吸收硫酸工业尾气中的SO2,Na2SO3+SO2+H2O═2NaHSO3,所得混合液可电解循环再生(A为阳离子交换膜;B为阴离子交换膜).相关物料的传输与转化关系如图.下列说法不正确的是( )

| A. | Pt(Ⅱ)为阳极 | B. | 阳极区酸性增强 | ||
| C. | 图中的n<m | D. | 阴极电极反应式为2H++2e-═H2↑ |
4.下列物质之间的转化都能一步实现的是( )
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Al→Al2O3→Al(OH)3→NaAl(OH)4 | ||
| C. | N2→NH3→NO→NO2→HNO3→NO2 | D. | S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
11.下列指定反应的离子方程式正确的是( )
| A. | 向 NaOH 溶液中通入过量 C02:20H-+CO2=CO32-+H2O | |
| B. | 电解氯化镁溶液:2C1-+2H20$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+20H- | |
| C. | 向 H202 溶液中加入 Mn02:2H202+4H++Mn02=02↑+Mn2++4H20 | |
| D. | 向KAl(SO2)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:Al3++2SO42-+2Ba2++40H-=A1O2-+2BaS04+2H20 |
8. 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 放电时左侧的电解质储罐中的离子总浓度增大 | |
| B. | 放电时负极的电极反应式为 Zn-2e-═Zn2+ | |
| C. | 充电时电极a为电源的负极 | |
| D. | 阳离子交换膜可阻止 Br2和Zn 直接发生反应 |
9.下列叙述正确的是( )
| A. | O2的相对分子质量为32 | |
| B. | 1molCO2的质量为44g/mol | |
| C. | H2SO4的摩尔质量为98 | |
| D. | 标准状况下,气体摩尔体积约为22.4L |
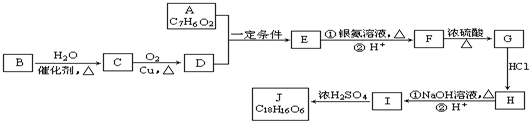
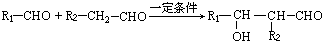
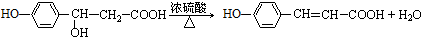
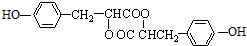 .
.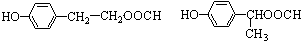 任意一种.
任意一种. 电解原理在化学工业中有着广泛的应用.现将某同学设计的原电池通过
电解原理在化学工业中有着广泛的应用.现将某同学设计的原电池通过