题目内容
11.下列指定反应的离子方程式正确的是( )| A. | 向 NaOH 溶液中通入过量 C02:20H-+CO2=CO32-+H2O | |
| B. | 电解氯化镁溶液:2C1-+2H20$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+20H- | |
| C. | 向 H202 溶液中加入 Mn02:2H202+4H++Mn02=02↑+Mn2++4H20 | |
| D. | 向KAl(SO2)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:Al3++2SO42-+2Ba2++40H-=A1O2-+2BaS04+2H20 |
分析 A.二氧化碳过量反应生成碳酸氢钠;
B.氢氧化镁为沉淀应保留化学式;
C.不符合反应客观事实;
D.KAl(SO2)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全,生成硫酸钡沉淀和偏铝酸钾和水.
解答 解:A.向 NaOH 溶液中通入过量 C02,离子方程式:0H-+CO2=HCO3-,故A错误;
B.电解氯化镁溶液,离子方程式:Mg2++2C1-+2H20$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2Mg(0H)2↓,故B错误;
C.向 H202 溶液中加入 Mn02,离子方程式:2H202$\frac{\underline{\;二氧化锰\;}}{\;}$02↑+2H20,故C错误;
D.向KAl(SO2)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全,离子方程式:Al3++2SO42-+2Ba2++40H-=A1O2-+2BaS04+2H20,故D正确;
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分,注意离子反应遵循客观规律、遵循原子个数、电荷数守恒规律,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
相关题目
1.下列离子方程式书写正确的是( )
| A. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe2++2Br2+6Cl- | |
| B. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O | |
| C. | 酚酞滴入碳酸钠溶液中,溶液变红:CO32-+H2O═HCO3-+OH- | |
| D. | 将铝条投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ |
2.从下列事实所列出的相应结论正确的是( )
| 实 验 事 实 | 结 论 | |
| ① | Cl2的水溶液可以导电 | Cl2是电解质 |
| ② | 将烧红的铁片插入水中生成氢气 | 还原性:Fe>H2 |
| ③ | 向久置空气的漂白粉中加盐酸有CO2气体产生 | 酸性:H2CO3>HClO |
| ④ | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠浓溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定含有NH4+ |
| A. | ③④⑤ | B. | ②③⑤ | C. | ①②③ | D. | 全部 |
19.自然界各种原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,并向深部渗透时,遇到闪锌矿(ZnS)和方铅矿(PbS),便慢慢地转变为铜蓝(CuS),下列有关该过程的解释及说法不合理的是( )
| A. | 原生铜的硫化物具有还原性 | |
| B. | 常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水 | |
| C. | 铜蓝的形成过程是:ZnS(S)+Cu2+?CuS(S)+Zn2+ | |
| D. | 硝酸型酸雨不利于铜蓝的形成:CuS+2H+═Cu2++H2S↑ |
6.如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )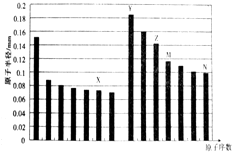

| A. | Y、Z两种元素的离子半径相比前者较大 | |
| B. | M、N两种元素的气态氢化物的稳定性相比后者较强 | |
| C. | M的氧化物既能碱反应又能和氢氟酸反应,但是该氧化物是典型的酸性氧化物 | |
| D. | 工业上常用的电解Y和N形成的化合物的水溶液制取Y的单质 |
16.将纯锌片和纯铜片按图所示方式插入稀硫酸中一段时间,以下叙述正确的是( )


| A. | 铜片表面发生氧化反应 | B. | 电子从铜片流向锌片 | ||
| C. | 电流从锌片流向铜片 | D. | 锌片为负极铜片为正极 |
3.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后[Cu(H2O)4]2+的数目不变 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 向反应后的深蓝色溶液中加入乙醇,不会产生任何现象 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下4.4 g乙醛所含σ键数目为0.7NA | |
| C. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
1.用惰性电极电解2mol•L-1下列物质的溶液,电解前后溶液的pH保持不变的是( )
| A. | H2SO4 | B. | NaOH | C. | Na2SO4 | D. | NaCl |