题目内容
19. (1)向含有等物质的量的SO32-、Fe2+、Br-、I-的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系如图所示.
(1)向含有等物质的量的SO32-、Fe2+、Br-、I-的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系如图所示.①原溶液中各离子的物质的量是0.1mol
②通入C123.36L时,溶液中发生反应的离子方程式有SO32-+Cl2+H2O=SO42-+2Cl-+2H+、2I-+Cl2=I2+2Cl-.
(2)某溶液中仅含如表中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均为0.01mol.
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
b若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变
c若向溶液中加入BaCl2溶液,有白色沉淀生成.
试回答下列问题:
①原溶液中所含的阴离子是NO3-、Cl-、SO42-;
②若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体是CuO、Fe2O3(写化学式);
③若向原溶液中加入过量盐酸,写出该过程中发生反应的离子方程式3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
分析 (1)①由图3.36L到4.48L,是氯气与亚铁离子反应,消耗氯气的物质的量为:$\frac{4.48-3.36}{22.4}$=0.05mol,而Cl2~2Fe2+,所以n(Fe2+)=0.05mol×2=0.1mol,而等物质的量的SO32-、Fe2+、Br-、I-的溶液中,所以各离子的物质的量都为0.1mol;
②还原性SO32->I->Fe2+>Br-,所以氧化亚铁离子前SO32-和I-已被完全氧化,反应的离子方程式为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+、2I-+Cl2=I2+2Cl-;
(2)若向溶液中加入KSCN溶液,无明显变化,说明原溶液中不含Fe3+;若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和还原性的Fe2+,若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有SO42-,各离子的物质的量均为0.1mol,根据电荷守恒可知还应含有Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是氧化铁和氧化铜.
解答 解:(1)①由图3.36L到4.48L,是氯气与亚铁离子反应,消耗氯气的物质的量为:$\frac{4.48-3.36}{22.4}$=0.05mol,而Cl2~2Fe2+,所以n(Fe2+)=0.05mol×2=0.1mol,而等物质的量的SO32-、Fe2+、Br-、I-的溶液中,所以各离子的物质的量都为0.1mol,故答案为:0.1;
②还原性SO32->I->Fe2+>Br-,所以氧化亚铁离子前SO32-和I-已被完全氧化,反应的离子方程式为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+、2I-+Cl2=I2+2Cl-,故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+、2I-+Cl2=I2+2Cl-;
(2)①若向溶液中加入KSCN溶液,无明显变化,说明原溶液中不含Fe3+;若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和还原性的Fe2+,若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有SO42-,各离子的物质的量均为0.1mol,根据电荷守恒可知还应含有Cu2+,所以原溶液中所含阳离子是Fe2+、Cu2+;阴离子是NO3-、Cl-、SO42-,
故答案为:NO3-、Cl-、SO42-;
②原溶液中所含阳离子是Fe2+、Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是CuO、Fe2O3,故答案为:CuO、Fe③加入盐酸,具有氧化性的NO3-和还原性的Fe2+发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
点评 本题考查物质的检验、鉴别以及方程式的有关计算,题目难度中等,解答本题的关键是把握有关反应的化学方程式的书写.

| A. | N2的生成速率与NH3的分解速率相等 | |
| B. | 单位时间内生成nmolN2的同时生成3nmolH2 | |
| C. | N2、H2、NH3的浓度不再发生变化 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
如表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编 号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1mol•L-1KI溶液 | 0.1mol•L-1H2O | X 0.1mol•L-1溶液 | 0.1mol•L-1双氧水 | 0.1mol•L-1稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1.2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响.实验2中m=20.0,n=20.0
(2)一定温度下,H2O2+2H++2I-→2H2O+I2反应速率可以表示为v=k•ca(H2O2)•cb (I-)•c(H+)(k为常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=1.4min.
②根据上表数据可知,a.b的值依次为1和1.
(3)实验5表明:硫酸铁能提高反应速率.
①催化剂能加快反应速率是因为催化剂降低(填“提高”或“降低”)了反应活化能.
②试用离子方程式表示Fe2(SO4)3对H2O2+2H++2I-→2H2O+I2催化的过程.(不必配平)
| A. | 玻璃、水泥、水晶都是硅酸盐制品 | |
| B. | 将秸秆焚烧可得富含钾肥的草木灰,焚烧是一种较为理想的秸秆处理办法 | |
| C. | 石油的分馏和煤的气化、液化,涉及的都是物理变化 | |
| D. | 纤维素不能被人体消化吸收,但能促进肠道的蠕动,对人体有益 |
| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 将某有机物滴入高锰酸钾溶液中 | 高锰酸钾溶液褪色 | 该有机物一定含不饱和键 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 向某淡黄色试液X中滴加少许NaOH溶液 | 试液X中出现红褐色沉淀 | 说明试液X中一定含有FeCl3 |
| D | 向装有少许无水硫酸铜的试管中加入乙醇 | 固体由白变蓝 | 该乙醇中一定含有水 |
| A. | A | B. | B | C. | C | D. | D |

 .
. .
. .
. .
. (写结构简式):
(写结构简式):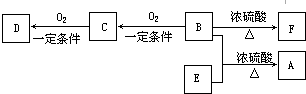
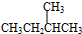 与
与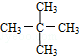 G.
G.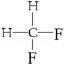 与
与 
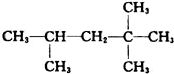 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:CH3C(CH3)2C(CH3)2CH3;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:CH3C(CH3)2C(CH3)2CH3;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为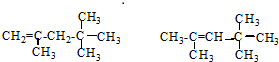 .
.