题目内容
16.过量铁与少量稀硫酸反应,为了加快反应速率,但是又不影响生成氢气的总量,可以采取的措施是( )| A. | 加入几滴硫酸铜溶液 | B. | 加入适量的水 | ||
| C. | 加入适量NaCl溶液 | D. | 再加入少量稀硫酸 |
分析 过量铁与少量稀硫酸反应,为了加快反应速率,该升高温度、增大铁固体的表面积或形成原电池反应,不影响生成氢气的总量,所加入物质不能改变氢离子的总物质的量,以此解答该题.
解答 解:A.加入几滴硫酸铜溶液,置换出铜,形成原电池反应,反应速率增大,由于铁过量,则生成氢气的总量不受影响,故A正确;
B.加入适量的水,硫酸浓度降低,反应速率减小,故B错误;
C.加入适量NaCl溶液,硫酸浓度降低,反应速率减小,故C错误;
D.再加入少量稀硫酸,影响生成氢气的总量,故D错误.
故选A.
点评 本题考查影响化学反应速率的因素,为高频考点,侧重于学生的分析能力的考查,注意熟悉物质之间的反应,题目难度不大.

练习册系列答案
 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
6.下列说法不能说明H3PO4的酸性弱于H2SO4的是( )
| A. | 非金属性P<S | |
| B. | H3PO4溶液的导电能力弱于H2SO4溶液 | |
| C. | Na3PO4溶液呈碱性,Na2SO4溶液呈中性 | |
| D. | H2SO4溶液与Na3PO4反应可以生成H3PO4和Na2SO4 |
7.下列说法正确的是( )
| A. | 乙烷和氯气发生二氯取代反应,所得产物只有一种 | |
| B. | 糖类水解的最终产物一定是葡萄糖 | |
| C. | 淀粉和纤维素的组成都可以用(C6H10O5)n表示,所以它们既是同系物又是同分异构体 | |
| D. | 油脂是食物组成中的重要部分,也是产生能量最高的营养物质 |
11.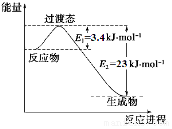 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图.
①写出该反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49 kJ•mol-1.
②能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
①在实验2条件下平衡常数K=0.17
②在实验3中,若平衡时CO转化率大于水蒸气转化率,则a/b 的值0<$\frac{a}{b}$<1(填具体值或范围).
③在实验4中,若保持990℃,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“>”、“=”或“<”)
(3)已知在常温下,甲醇是优质的清洁燃料,可制作燃料电池.
①已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H3=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(4)已知草酸是一种二元酸,草酸氢钠溶液显酸性.常温下向10Ml0.01mol/LH2C2O4溶液中滴加10mL0.01mol/LNaOH溶液时,比较溶液中各种离子浓度大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
(5)以甲醚空气氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池的负极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图.
①写出该反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49 kJ•mol-1.
②能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②在实验3中,若平衡时CO转化率大于水蒸气转化率,则a/b 的值0<$\frac{a}{b}$<1(填具体值或范围).
③在实验4中,若保持990℃,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“>”、“=”或“<”)
(3)已知在常温下,甲醇是优质的清洁燃料,可制作燃料电池.
①已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H3=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(4)已知草酸是一种二元酸,草酸氢钠溶液显酸性.常温下向10Ml0.01mol/LH2C2O4溶液中滴加10mL0.01mol/LNaOH溶液时,比较溶液中各种离子浓度大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
(5)以甲醚空气氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池的负极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
4.下列实验装置不能达到实验目的是( )

| A. | 比较非金属性强弱:Si弱于C,C弱于S | |
| B. | 用四氯化碳提取碘水中的碘单质 | |
| C. | 观察烧碱的焰色反应 | |
| D. | 比较NaHCO3和Na2CO3的热稳定性 |
5. 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )| A. | 氢铝化合物可能成为未来的燃料 | |
| B. | Al2H6中含有非极性键 | |
| C. | Al2H6是分子晶体 | |
| D. | Al2H6与水反应生成氢氧化铝和氢气 |
 已知有关热化学方程式为:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g)2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H-O:463,H-N:391,O=O:497
已知有关热化学方程式为:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g)2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H-O:463,H-N:391,O=O:497