题目内容
3.锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.完成下列填空: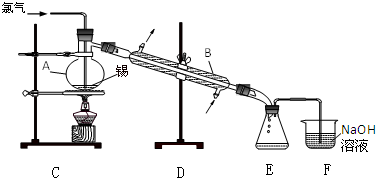
(1)仪器A的名称蒸馏烧瓶;仪器B的名称冷凝管.
(2)实验室制得的氯气中含HCl和水蒸气,须净化后再通入液态锡中反应,除去HCl的原因可能是Sn可能与HCl反应生成SnCl2;除去水的原因是防止SnCl4水解.
(3)图中尾气处理装置不够完善,改进的方法是E、F之间连装有碱石灰的干燥管:(可以画图,也可以用文字表述,需注明仪器、试剂及连接位置等).
(4)当锡熔化后,通入氯气开始反应,即可停止加热,其原因是Sn和Cl2反应放出大量的热.若反应中用去锡粉11.9g,反应后在锥形瓶中收集到23.8g SnCl4,则SnCl4的产率为0.912.
(5)SnCl4遇水强烈水解的产物之一是白色的固态二氧化锡.若将SnCl4少许暴露于潮湿空气中,预期可看到的现象是出现白色烟雾.
(6)已知还原性Sn2+>I-,SnCl2也易水解生成难溶的Sn(OH)Cl.如何检验制得的SnCl4样品中是否混有少量的SnCl2?.
分析 氯气经除杂,干燥后与锡在蒸馏烧瓶中反应生成SnCl4,经冷却后在装置中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置中,以此解答该题.
(1)蒸馏装置中的仪器名称;
(2)Sn在金属活动性顺序表中排在H的前面,Sn可能与HCl反应生成SnCl2,故为了防止此反应的发生,需要除去氯气中的HCl,由于SnCl4极易水解,故此需要干燥的氯气;
(3)E收集产品,F中氢氧化钠溶液中水蒸气易挥发,进入E中,易使SnCl4水解.在E和F之间增加干燥装置可以避免此种情况发生;
(4)此反应过程放出大量的热,故反应开始后,依靠反应放出的热量即可使Sn熔化;
(5)四氯化锡遇水强烈水解生成SnO2、HCl,SnO2是固体颗粒,HCl结合空气中的水蒸气,出现白色烟雾;
(6)依据所给信息:还原性Sn2+>I-,那么若产品中混有SnCl2,应能氧化碘离子生成碘单质,碘单质遇淀粉变蓝,故实验步骤为:取样品少许,溶于稀盐酸中,加2滴碘的淀粉溶液,振荡,若紫色褪去,说明SnCl4混有少量的SnCl2,否则SnCl4纯净.
解答 解:(1)仪器A为蒸馏烧瓶,仪器B为冷凝管,又称为冷凝器,故答案为:蒸馏烧瓶;冷凝管;
(2)Sn能与HCl反应生成SnCl2,SnCl4极易水解,故需要干燥的氯气,故答案为:Sn可能与HCl反应生成SnCl2;防止SnCl4水解;
(3)F中氢氧化钠溶液中水蒸气易挥发,进入E中,在E和F之间增加干燥装置,故答案为:E、F之间连装有碱石灰的干燥管;
(4)反应放出的热量即可使Sn熔化,11.9gSn粉的物质的量为:$\frac{11.9g}{119g/mol}$=0.1mol,故应生成SnCl4极的物质的量为0.1mol,即质量为:0.1mol×(119+4×35.5)g/mol=26.1g,产率=$\frac{23.8g}{26.1g}$×100%≈91.2%,故答案为:Sn和Cl2 反应放出大量的热; 0.912;
(5)四氯化锡遇水强烈水解生成SnO2、HCl,HCl结合空气中的水蒸气,出现白色烟雾,故答案为:出现白色烟雾;
(6)还原性Sn2+>I-,那么若产品中混有SnCl2,应能氧化碘离子生成碘单质,碘单质遇淀粉变蓝,故实验步骤为:取样品少许,溶于稀盐酸中,加2滴碘的淀粉溶液,振荡,若紫色褪去,说明SnCl4混有少量的SnCl2,否则SnCl4纯净,故答案为:取样品少许,溶于稀盐酸中,加2滴碘的淀粉溶液,振荡,若紫色褪去,说明SnCl4混有少量的SnCl2,否则SnCl4纯净.
点评 本题主要考查的是制备实验方案的设计,综合性较强,难度较大,涉及知识点:实验室常见仪器、盐类水解原理、氧化还原反应原理等,充分利用所给信息是解决本题的关键.

 名校课堂系列答案
名校课堂系列答案| A. | 烧碱、纯碱、熟石灰均属于碱 | |
| B. | 稀豆浆、FeCl3溶液、牛奶均属于胶体 | |
| C. | HCl、BaSO4、NH3•H2O均属于电解质 | |
| D. | MgO、CuO、Na2O2均属于碱性氧化物 |
| A. | 除去CO2中混有的少量SO2,可将气体通过酸性高锰酸钾溶液 | |
| B. | 除去SiO2中混有的少量Al2O3,可以用NaOH溶液洗涤 | |
| C. | 除去Fe粉中的少量Mg粉,可以将该粉末用稀硝酸洗涤,然后过滤 | |
| D. | 除去NO2气体中混有的少量NO气体,可以向该气体中充入过量空气 |
| A. | 原CuSO4溶液的浓度为0.1mol/L | |
| B. | 反应过程中共转移0.02mol电子 | |
| C. | 向电解后的溶液中加入适量CuO,可恢复到原溶液 | |
| D. | 阳极周围溶液的pH减小 |
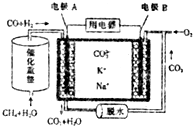
| A. | 电流方向:由B极经用电器流向A极 | |
| B. | 电极B上发生的电极反应为2CO2+O2+4e-═CO22- | |
| C. | 电池工作时,K+、Na+向电极B移动 | |
| D. | 若消耗电极B上的O233.6L(标准状况),则至少需要1moL CH4参加反应 |
| A. | 氯化钙溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3↓+2H+ | |
| B. | 硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+=Fe3++4H2O | |
| C. | 少量的CO2 通人NaOH溶液中:CO2+2OH-=CO32-+H2O | |
| D. | 次氯酸钙溶液中通人少量SO2气体:Ca2++2ClO一+SO2+H2O=CaSO3↓+2HClO |
①ClO3-+5Cl-+6H+═3Cl2+3H2O
②2FeCl3+2KI═2FeCl2+2KCl+I2
③2FeCl2+Cl2═2FeCl3.
| A. | ClO3->Cl2>I2>Fe3+ | B. | Cl2>ClO3->I2>Fe3+ | ||
| C. | ClO3->Cl2>Fe3+>I2 | D. | ClO3->Fe3+>Cl2>I2 |
