题目内容
15.下列离子方程式书写正确的是( )| A. | 氯化钙溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3↓+2H+ | |
| B. | 硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+=Fe3++4H2O | |
| C. | 少量的CO2 通人NaOH溶液中:CO2+2OH-=CO32-+H2O | |
| D. | 次氯酸钙溶液中通人少量SO2气体:Ca2++2ClO一+SO2+H2O=CaSO3↓+2HClO |
分析 A.氯化钙溶液不和二氧化碳反应;
B.硫酸亚铁溶液与过氧化氢溶液反应生成硫酸铁和水,方程式左右电荷不守恒;
C.少量的CO2 通人NaOH溶液中生成碳酸钠和水;
D.次氯酸根具有强的氧化性,能够将二氧化硫氧化生成硫酸根离子.
解答 解:A.氯化钙溶液中通入二氧化碳气体不能反应.故A错误;
B.硫酸亚铁溶液与过氧化氢溶液混合,离子方程式:2Fe2++H2O2+2H+═2Fe3++2H2O,故B错误;
C.少量的CO2 通人NaOH溶液中,生成碳酸钠和水,反应的离子方程式为:CO2+2OH-=CO32-+H2O,故C正确;
D.次氯酸钙溶液中通人少量SO2气体,离子方程式为:SO2 +ClO-+Ca2++H2O=CaSO4↓+Cl-+2H+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写方法和注意问题,明确化学反应的实质是解题关键,易错选项是D,注意次氯酸的强氧化性,为易错点,题目难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
20.向含b mol Na2CO3的溶液中缓慢滴加含a mol HCl溶液,并不断振荡,下列说法不正确的是( )
| A. | 当$\frac{a}{b}$>2时,发生的离子反应为:CO32-+H+═HCO3-,HCO3-+H+═CO2↑+H2O | |
| B. | 当0<$\frac{a}{b}$<1时,发生的离子反应为:CO32-+H+═HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:2CO32-+3H+═HCO3-+CO2↑+H2O | |
| D. | 当1<$\frac{a}{b}$<2时,溶液中n(HCO3-)为(2a-b)mol |
1.对于有气体参加的反应,一定能使化学反应速率加快的因素是( )
①扩大容器的容积 ②使用催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容积 ⑥增大容器内的压强.
①扩大容器的容积 ②使用催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容积 ⑥增大容器内的压强.
| A. | ②③ | B. | ②③④⑥ | C. | ②④⑤ | D. | ③④⑥ |
10.向某溶液里加入过量的氨水或过量的氢氧化钠溶液,均有沉淀产生;若加入铁粉或铜粉,溶液的质量都增加,则该溶液里一定含有下列离子中的( )
| A. | Al3+ | B. | Fe2+ | C. | Fe3+ | D. | Cu2+ |
20.下列反应的离子方程式正确的是( )
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| B. | 向偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 向NH4HCO3稀溶液中滴加过量Ca(OH)2溶液:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| D. | 向CuSO4溶液中滴加过量氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ |
7.下列有关溶液中离子存在和转化的表达合理的是( )
| A. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O | |
| B. | 标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
4.水晶是重要的首饰用品,其主要成分是SiO2,下列有关SiO2的说法正确的是( )
| A. | 水晶能溶于水生成H2SiO3 | |
| B. | SiO2是酸性氧化物,不能与任何酸反应 | |
| C. | SiO2既能溶于NaOH溶液,又能溶于HF,因此属于两性氧化物 | |
| D. | SiO2对应的H2SiO3是一种弱酸,酸性比碳酸还弱 |
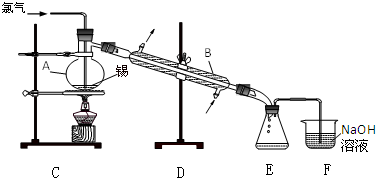
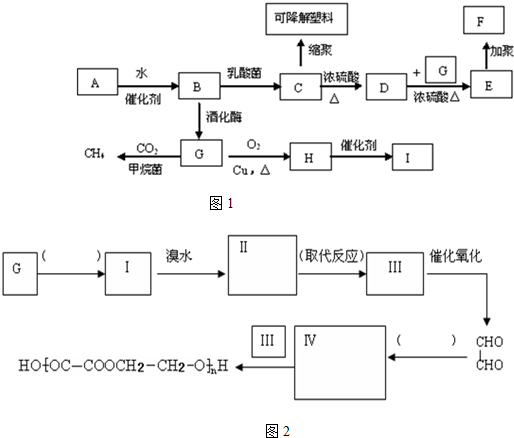
 六元环状化合物I
六元环状化合物I
 .
. 的合成路线如图2:(按要求填写,消去反应;氧化反应内填写反应类型,内填写Ⅱ和Ⅳ的结构简式)
的合成路线如图2:(按要求填写,消去反应;氧化反应内填写反应类型,内填写Ⅱ和Ⅳ的结构简式)