题目内容
8.一种熔融碳酸盐燃料电池的工作原理如图.下列有关该电池的说法不正确的是( )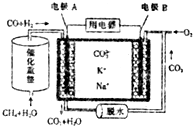
| A. | 电流方向:由B极经用电器流向A极 | |
| B. | 电极B上发生的电极反应为2CO2+O2+4e-═CO22- | |
| C. | 电池工作时,K+、Na+向电极B移动 | |
| D. | 若消耗电极B上的O233.6L(标准状况),则至少需要1moL CH4参加反应 |
分析 原电池工作时,CO和H2失电子在负极发生氧化反应,则A为负极,CO和H2被氧化生成二氧化碳和水,正极B上为氧气得电子生成CO32-,以此解答该题.
解答 解:A.A为负极,B为正极,电流由正极B经用电器流向负极A,故A正确;
B.B为正极,正极为氧气得电子生成CO32-,反应为O2+2CO2+4e-=2CO32-,故B错误;
C.电池工作时,阳离子向正极移动,即K+、Na+向电极B移动,故C正确;
D.催化重整反应的化学方程式为CH4+H2O=CO+3H2,电池总反应为CO+3H2+2O2=CO2+3H2O,当1mol甲烷参与反应时,消耗氧气2mol,标况下的体积为44.8L,故D错误;
故选BD.
点评 本题考查了化学燃料电池,明确电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.

练习册系列答案
相关题目
13.下列表示正确的是( )
| A. | CO2的电子式: | B. | 乙烯的结构式:CH2═CH2 | ||
| C. | CH4的比例模型: | D. | Cl-离子的结构示意图: |
14.工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3•9H2O]的流程如下:

下列说法错误的是( )

下列说法错误的是( )
| A. | 试剂X选用稀硝酸最合适 | |
| B. | 滤渣Y的主要成分为Fe2O3 | |
| C. | 反应I 中发生的反应之一为Al2O3+2OH-=2AlO2-+H2O | |
| D. | 减压蒸发结晶不能改为常压蒸发结晶 |
13.下图中能验证氯化钠溶液(含酚酞)电解产物的装置是( )
| A. |  氢氧化钠溶液 | B. |  淀粉碘化钾溶液 | C. |  氢氧化钠溶液 | D. |  淀粉碘化钾溶液 |
20.下列反应的离子方程式正确的是( )
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| B. | 向偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 向NH4HCO3稀溶液中滴加过量Ca(OH)2溶液:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| D. | 向CuSO4溶液中滴加过量氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ |
17.下列物质中,分子内和分子间均可形成氢键的是( )
| A. | NH3 | B. | B | C. | H2O | D. | C2H5OH |
18.下列说法正确的是( )
| A. | 按分散剂可将分散系分为溶液、胶体和浊液 | |
| B. | 元素周期表中含金属元素最多的是 IA族 | |
| C. | Na2O2、CH3F、NH4Cl、Ba(OH)2均为离子化合物 | |
| D. | 漂白粉、福尔马林、钢、王水、氯水均为混合物 |