题目内容
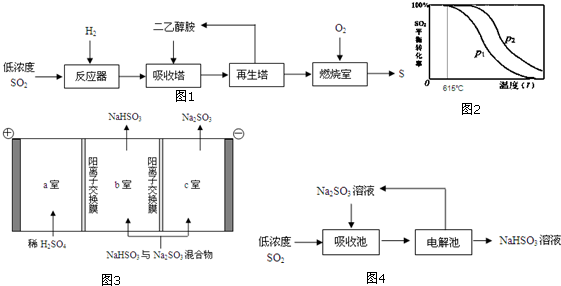
16. CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )
CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )| A. | P1<P2 | B. | 该反应的△H>0 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |
分析 A.温度升高、增大压强均使该反应的化学反应速率加快;
B.由图可知,升高温度,平衡逆向移动,说明该反应的△H<0;
C.平衡常数只与温度有关;
D.设向密闭容器充入了1molCO和2molH2,利用三段法进行数据分析计算.
解答 解:A.由300℃时,增大压强,平衡正向移动,CH3OH的体积分数增大,所以p1>p2,故A错误;
B.图可知,升高温度,CH3OH的体积分数减小,平衡逆向移动,则该反应的△H<0,故B错误;
C.A、B处的温度不同,平衡常数与温度有关,故平衡常数不等,故C错误;
D.设向密闭容器充入了1molCO和2molH2,CO的转化率为x,则
CO(g)+2H2(g)═CH3OH(g)
起始 1 2 0
变化 x 2x x
结束 1-x 2-2x x
在C点时,CH3OH的体积分数=$\frac{x}{1-x+2-2x+x}$=0.5,解得x=0.75,故D正确;
故选D.
点评 本题考查了图象和化学平衡的关系,为高频考点,难度中等,重在培养学生图象与化学平衡理论的相互关系.

练习册系列答案
相关题目
6.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
7.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)═2NO2(g)△H=+133kJ•mol-1
H2O(g)═H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是de.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
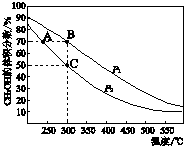
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.
(2)改变温度,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)<K(Ⅱ)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(Ⅰ)<c(Ⅱ).
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1 ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)═2NO2(g)△H=+133kJ•mol-1
H2O(g)═H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是de.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.

(2)改变温度,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1 ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
4.有机物克伦特罗(Clenbuterol)结构如图所示.下列有关克伦特罗的叙述,不正确的是( ) 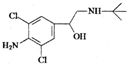

| A. | 该物质的分子式为C12H18ON2Cl2 | |
| B. | 该物质易溶于盐酸 | |
| C. | 该物质的1H核磁共振谱图中有8个吸收峰 | |
| D. | 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等 |
11.你认为下列对化学知识概括合理的组合是( )
①金属晶体中存在离子,但却不存在离子键
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体硬度一般比分子晶体大,分子晶体熔点不一定比金属晶体低
④固态能导电的一定是金属晶体
⑤NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能小
⑥原子晶体一定由原子构成,由原子构成的晶体不一定是原子晶体
⑦共价化合物中可能含有离子键
⑧金属晶体中简单立方堆积的配位数是8,空间利用率最低.
①金属晶体中存在离子,但却不存在离子键
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体硬度一般比分子晶体大,分子晶体熔点不一定比金属晶体低
④固态能导电的一定是金属晶体
⑤NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能小
⑥原子晶体一定由原子构成,由原子构成的晶体不一定是原子晶体
⑦共价化合物中可能含有离子键
⑧金属晶体中简单立方堆积的配位数是8,空间利用率最低.
| A. | 只有②③④ | B. | 只有②③⑦ | C. | 只有①③⑥ | D. | 只有⑤⑥⑧ |
1.X、Y均为第3周期主族非金属元素,且Y的族序数大于X的族序数.下列说法正确的是( )
| A. | 原子序数:X>Y | |
| B. | 非金属性:X>Y | |
| C. | 最高价氧化物对应的水化物酸性:X>Y | |
| D. | 原子半径:X>Y |
5.下列实验操作与预期的实验结论或实验目的一致的是( )
| 选项 | 实验操作及现象 | 实验结论或实验目的 |
| A | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 溶液中有Na+,无K+ |
| B | 向硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 非金属性:Cl>Si |
| C | 向Ba(NO3)2溶液中通入SO2,有白色沉淀产生 | SO2具有还原性 |
| D | 将含少量KNO3杂质的NaCl晶体制成热的饱和溶液,冷却结晶,过滤 | 除去NaCl中的KNO3杂质 |
| A. | A | B. | B | C. | C | D. | D |
 (1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)
(1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)