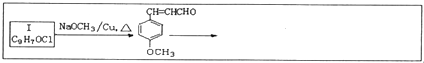
题目内容
1.在一个恒容绝热的容器内发生反应:mA(g)+nB(g)?pC(s)+qQ(g)当m、n、p、q为任意数时,达到平衡的标志是:( )①体系的气体密度不再改变 ②体系的温度不再改变 ③生成物C的浓度不再改变
④气体的总质量不再改变 ⑤反应速率n v(A)=m v(B)
⑥单位时间内m mol A断键反应,同时q mol Q也断键反应.
| A. | ①②④⑤ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ①②④⑥ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①体系的气体密度不再改变,说明气体的物质的量不变,反应达平衡状态,故正确;
②体系的温度不再改变,说明正逆反应速率相等,达平衡状态,故正确;
③生成物C的浓度一直不变,故错误;
④气体的总质量不再改变,说明正逆反应速率相等,达平衡状态,故正确;
⑤反应速率n v(A)=m v(B),未说明正与逆的关系,故错误;
⑥单位时间内m mol A断键反应,等效于q mol Q形成,同时q mol Q也断键反应,正逆反应速率相等,达平衡状态,故正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
6.下列化学反应中,属于氧化还原反应的是( )
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | NH3+HCl═NH4Cl | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | Cl2+2NaOH=NaCl+NaClO+H2O |
16.下列说法正确的是( )
| A. | 氢氧燃料电池工作时,1mol H2在正极上失去2mol电子 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的CO32-的数目小于6.02×1022个 | |
| C. | 常温常压下,22.4LCl2中含有的分子数为6.02×1023个 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力减弱 |
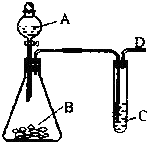 某同学用如图所示的装置来探究SO2的性质及有关实验.
某同学用如图所示的装置来探究SO2的性质及有关实验.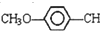 =CHCOOCH2CH2CH(CH3)2合成路线如下:
=CHCOOCH2CH2CH(CH3)2合成路线如下: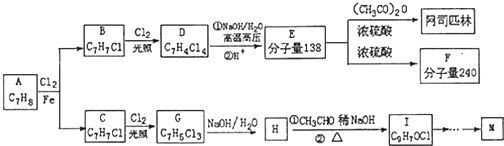
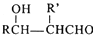 $\stackrel{△}{→}$RCH═
$\stackrel{△}{→}$RCH═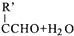
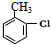 ,H→I两步反应的反应类型加成反应、消去反应
,H→I两步反应的反应类型加成反应、消去反应
 任意1种.
任意1种.