题目内容
9.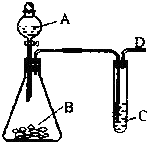 某同学用如图所示的装置来探究SO2的性质及有关实验.
某同学用如图所示的装置来探究SO2的性质及有关实验.(1)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出该反应的化学方程式Na2SO3+H2SO4═Na2SO4+SO2↑+H2O.
(2)将制取的SO2气体通入C溶液中,请回答下列问题:
①若C溶液是紫色石蕊试液,通入少量SO2气体后,现象是紫色溶液变为红色 红色不褪去(或溶液颜色无变化).
②若C溶液是橙色的溴水溶液,通入SO2气体后现象是溴水褪色,写出反应的离子方程式SO2+Br2+2H2O═4H++SO42-+2Br-.
③若C溶液是澄清石灰水,缓慢且持续通入SO2气体过程中,观察到的现象是首先有白色沉淀生成,然后白色沉淀消失,写出相关反应的化学方程式SO2+Ca(OH)2=CaSO3↓+H2O,SO2+CaSO3+H2O=Ca(HSO3)2.
分析 (1)亚硫酸是弱酸,硫酸是强酸,用亚硫酸钠固体与硫酸反应制取SO2气体,是利用强酸制弱酸的原理,根据元素守恒书写化学方程式;
(2)①酸使紫色石蕊试液变红,二氧化硫不能漂白指示剂;
②二氧化硫与溴水发生氧化还原反应;
③二氧化硫通入到澄清石灰水中先生成亚硫酸钙沉淀,后沉淀溶解生成亚硫酸氢钙.
解答 解:(1)亚硫酸是弱酸,硫酸是强酸,用亚硫酸钠固体与硫酸反应制取SO2气体,反应中生成的亚硫酸立即分解生成二氧化硫,反应方程式为Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(2)①二氧化硫溶于水生成亚硫酸,亚硫酸使紫色溶液变为红色;二氧化硫虽有漂白性,但它不能使指示剂褪色,所以实验现象为紫色溶液变为红色,红色不褪去(或溶液颜色无变化),
故答案为:紫色溶液变为红色,红色不褪去(或溶液颜色无变化);
②溴水与二氧化硫发生氧化还原反应,溴被二氧化硫中+4价的硫还原成-1价的溴,+4价的硫被溴氧化成+6价的硫,溴水褪色,反应的离子方程式为SO2+Br2+2H2O═4H++SO42-+2Br-,
故答案为:溴水褪色; SO2+Br2+2H2O═4H++SO42-+2Br-;
③二氧化硫通入到澄清石灰水中少量时反应为:SO2+Ca(OH)2=CaSO3↓+H2O,二氧化硫过量时:SO2+CaSO3+H2O=Ca(HSO3)2,所以观察到的现象 为首先有白色沉淀生成,然后白色沉淀消失,
故答案为:首先有白色沉淀生成,然后白色沉淀消失;SO2+Ca(OH)2=CaSO3↓+H2O,SO2+CaSO3+H2O=Ca(HSO3)2.
点评 该题主要考查了二氧化硫的制取以及二氧化硫漂白与被氧化的区别,解题时需从化合价角度分析漂白与被氧化的区别,才能正确解题.

 名校课堂系列答案
名校课堂系列答案| A. | 常温常压下,等质量的N2和CO气体的原子数均为2NA | |
| B. | 在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA | |
| C. | 含有3mol离子的过氧化钠固体和足量的水反应,电子转移数为NA | |
| D. | 标准状况下,2.24 L CCl4含有的分子数为0.1NA |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加KIO3 |
| D | 向苯酚钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 气体的摩尔体积约为22.4 mol•L-1 | |
| B. | 标准状况下9gH2O体积约为11.2L | |
| C. | 在100 mL水中溶解5.85 g NaCl,则所得NaCl溶液的物质的量浓度为1 mol•L-1 | |
| D. | 同温同压下,相同体积的任何气体所含物质分子的物质的量一定相同 |
| A. | CuSO4只是还原剂 | |
| B. | Cu3P既是氧化产物又是还原产物 | |
| C. | P既是氧化剂又是还原剂 | |
| D. | 若有11 mol P参加反应,转移电子的物质的量为60 mol |
①体系的气体密度不再改变 ②体系的温度不再改变 ③生成物C的浓度不再改变
④气体的总质量不再改变 ⑤反应速率n v(A)=m v(B)
⑥单位时间内m mol A断键反应,同时q mol Q也断键反应.
| A. | ①②④⑤ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ①②④⑥ |
(2)$\frac{1}{2}$N2 (g)+O2(g)═NO2(g)△H=+33.9kJ/mol
(3)$\frac{1}{2}$N2 (g)+$\frac{3}{2}$H2(g)═NH3(g)△H=-46.0kJ/mol
计算NH3(g)燃烧生成NO2(g)和H2O(g)的燃烧热( )
| A. | 282.8 kJ/mol | B. | -282.8 kJ/mol | C. | 848.4kJ/mol | D. | -848.4 kJ/mol |
 如图所示进行实验:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.已知集气瓶的容积为150mL.氧气的密度为1.4g/L,为了节约药品.理论上所取硫的质量不能超过多少克?(要写过程,计算结果保留两位小数)
如图所示进行实验:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.已知集气瓶的容积为150mL.氧气的密度为1.4g/L,为了节约药品.理论上所取硫的质量不能超过多少克?(要写过程,计算结果保留两位小数)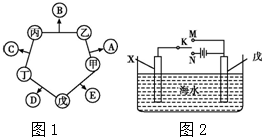 甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图1所示.又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属.②乙在甲中
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图1所示.又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属.②乙在甲中 .
.